| |
REMI envía todos sus contenidos gratuitamente por correo electrónico a más de 7.100 suscriptores. [Suscripción]
Dosis óptima de diálisis en pacientes con fallo renal agudo:
una revisión crítica de la literatura
[Versión para imprimir] [PDF 14 pág 663 Kb]
El contenido de este artículo fue presentado en gran parte dentro de un debate pro-con celebrado dentro del XLIV Congreso de la SEMICUYC (Valladolid, 7-10 de junio de 2009). [Ver las recomendaciones finales]
Introducción
El problema de la dosis óptima de diálisis en pacientes con fallo renal agudo ha sido objeto de larga controversia [1-3]. En los últimos años, y en especial a partir de la publicación del ensayo del grupo de Vicenza [4], las principales guías de práctica clínica [5, 6] han venido recomendando en estos pacientes una dosis de ultrafiltrado de al menos 35 ml/kg/h (la llamada “dosis de insuficiencia renal aguda”), sensiblemente más alta que la dosis usada tradicionalmente de 20 ml/kg/h. Desde mediados de 2008, sin embargo, diversos estudios, entre los que destaca el ensayo ATN [7], han cuestionado seriamente estas recomendaciones.
El objetivo de este estudio es revisar críticamente la evidencia procedente de ensayos clínicos aleatorizados acerca de la efectividad de las dosis altas en comparación con las dosis tradicionales en pacientes con daño renal agudo, en términos de mortalidad y recuperación de la función renal.
No se abordará, por tanto, la evidencia procedente de estudios de experimentación animal, las series clínicas sin grupo control, ni los estudios que evalúan desenlaces clínicos intermedios sin interés primario para el paciente, como el aclaramiento de mediadores. Dada la imposibilidad de realizar estudios doble ciego en este campo, tampoco se analizarán en profundidad aquellos desenlaces clínicos bajo el control del investigador, como la duración de la estancia en cuidados intensivos o la duración de la ventilación mecánica. Finalmente, se tratará de hacer una síntesis narrativa de los resultados [8], y establecer unas recomendaciones actualizadas aplicando el sistema GRADE [9].
El estudio de dosis de Vicenza
Probablemente una de las claves para entender la controversia existente en este campo, radica en el artículo publicado por Ronco y col. en el año 2000 en la revista Lancet [4], al que algunos autores han considerado como el “big bang” de la era de la hemofiltración de alto volumen (HFAV) [10].
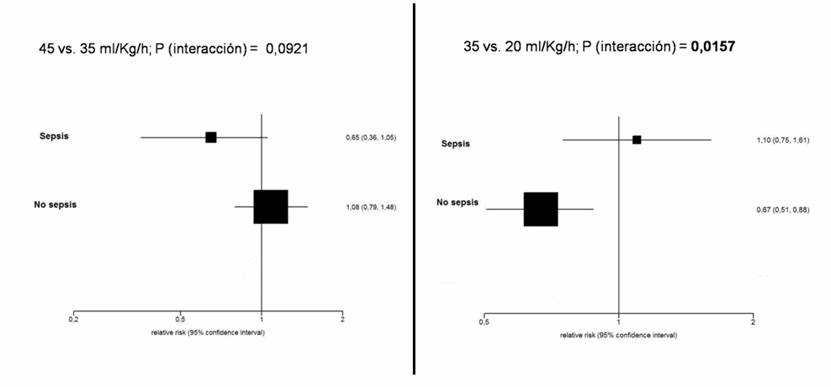
En este ensayo unicéntrico los pacientes con fallo renal agudo se asignaron aleatoriamente a uno de 3 brazos, que se trataron con una dosis convencional de ultrafiltración de 20 ml/kg/h, con 35 ml/kg/h o con 45 ml/kg/h. La supervivencia “a los 15 días de suspender el tratamiento” fue significativamente más baja en el grupo tratado con dosis tradicionales, mientras que fue similar en los grupos tratados con dosis de 35 o 45 ml/kg/h. En un análisis de subgrupos, sin embargo, los pacientes con sepsis parecían obtener un beneficio adicional con la dosis de 45 ml/kg/h comparada con la de 35 ml/kg/h.
Este ensayo -pionero de la HFAV- presenta, sin embargo, importantes deficiencias. En primer lugar, no se especifican con claridad los criterios de inclusión/exclusión (como veremos más adelante). Segundo, el desenlace clínico analizado (la supervivencia a los 15 días tras la última diálisis) es difícilmente homologable, y no se puede descartar que se trate de un resultado elegido a posteriori. Tercero, el estudio no especifica si se ocultó la secuencia de aleatorización, una característica que se asocia con una sobre-estimación del efecto de hasta un 30% [11, 12]. Cuarto, el estudio es muy parco en la descripción de las características basales de los pacientes, y por tanto resulta difícil saber si las diferencias observadas se deben a la dosis de diálisis aplicadas o al diferente pronóstico basal de los brazos analizados. Quinto, la mortalidad observada en el grupo control parece excesiva para la gravedad de los pacientes incluidos (un 28% más de la esperada), lo que podría explicar, al menos en parte, las diferencias observadas. En la escala de Jadad [13], el estudio alcanza una puntuación de 2, es decir, que el estudio se podría calificar como de “baja calidad”.
Tabla I. Supervivencia por subgrupos en el estudio de Vicenza |
| |
No sepsis |
Sepsis |
p |
| 20 ml/kg/h |
55/126 (44%) |
5/20 (25%) |
0,900 |
| 35 ml/kg/h |
76/122 (62%) |
3/17 (18%) |
0,001 |
| 45 ml/kg/h |
74/125 (59%) |
7/15 (47%) |
0,256 |
| |
Los resultados del análisis de subgrupos se resumen en la tabla I y en la figura 1. Tal como reconocen los autores, no existe una interacción estadísticamente significativa [14, 15] entre dosis de ultrafiltración y existencia de sepsis (es decir, que no existe un efecto de subgrupo estadísticamente significativo), pero parece que los pacientes con sepsis obtienen un beneficio adicional si se aplica una dosis de 45 ml/kg/h en lugar de la dosis de 35 ml/kg/h. En cualquier caso, si se da por bueno este resultado, también deberíamos aceptar los resultados de los otros subgrupos. Por ejemplo, si comparamos ahora los grupos de 35 frente a 20 ml/kg/h, la conclusión en este caso sería que las dosis de 35 ml/kg/h (las llamadas “dosis de fallo renal agudo”) sólo son efectivas en pacientes sin sepsis, mientras que en los pacientes con sepsis serían preferibles las dosis convencionales de 20 ml/kg/h. Y esta interacción sí es estadísticamente significativa.
Figura 1. Análisis de subgrupos (sepsis/no sepsis) en el estudio de Vicenza [4] |
|
Mención aparte merece la baja prevalencia de sepsis en este estudio (sólo un 15% de los pacientes), que parece poco coherente con el mecanismo de acción propuesto por los padres de la HFAV - la hipótesis de eliminación de los picos (“peak removal hypothesis”), la hipótesis del umbral de inmunomodulación (“the Honoré concept”) o la hipótesis de entrega de mediadores (“the Alexander concept”) [16-20]. Pues bien, los propios autores nos lo aclaran 6 años después, en una réplica a una carta al director de 2006 [21], en la que se dice literalmente que “los (…) pacientes con shock séptico fueron excluidos del ensayo de 2000“. Dicho de otra forma, los “fundamentos de la HFAV ” 19 se encuentran, sorprendentemente, en el análisis de un subgrupo de pacientes con sepsis incluidos en un estudio del que se excluían los pacientes con shock séptico.
Estudios anteriores a 2008
Con posterioridad al estudio de Ronco [4] se publicaron otros ensayos (ya sea con técnicas continuas o con técnicas intermitentes) que comparaban la mortalidad con las dosis convencionales frente a las dosis más altas.
En 2002, Bouman y col [22] publicaron un pequeño ensayo en el que los pacientes con fallo renal agudo fueron asignados aleatoriamente a un brazo con HFAV precoz (72-96 L/24 h), a un brazo de hemofiltración venovenosa continua (HFVVC) convencional precoz (24-36 L/24 h) o a un brazo de hemofiltración venovenosa continua (HFVVC) convencional tardía, sin que se encontraran diferencias significativas de mortalidad. Aunque frecuentemente se ha considerado este estudio como evidencia en contra de la HFAV, si se comparan exclusivamente los 2 grupos con hemofiltración precoz, el riesgo relativo es similar al del estudio de Ronco [4].
Ese mismo año Schiffl y col [23] publicaron un ensayo en el que los pacientes con fallo renal agudo se asignaban de forma alternante a diálisis intermitente diaria o a un grupo con diálisis intermitente convencional (3 a la semana). La mortalidad fue del 46% en el grupo control y se redujo hasta un sorprendente 28% en el grupo con tratamiento intensivo (P = 0,01). A pesar de su baja calidad metodológica (índice de Jadad de 1) el estudio tuvo un gran impacto bibliométrico, y algunas guías de práctica clínica incluyeron la recomendación de realizar sesiones diarias en pacientes con fracaso renal agudo tratado con diálisis intermitente [6].
En 2006, Saudan [24] publicó un ensayo en el que los pacientes se aleatorizaban a un grupo con HFVVC convencional o a uno con HDFVVC en el que a la dosis convencional de hemofiltración se añadía una dosis de diálisis (una técnica en principio poco apropiada para la eliminación de mediadores de la sepsis). Los resultados fueron asimismo espectaculares, con una mortalidad a los 90 días significativamente más baja en el grupo tratado con HDFVVC (41% frente al 66%).
Por lo tanto, los resultados de los ensayos disponibles anteriores a 2008 indicaban de forma consistente (I2 del 0%) una clara superioridad de las dosis altas frente a las convencionales en pacientes con daño renal agudo (riesgo relativo ponderado 0,69; IC 95% 0,60-0,80). Ello hizo que diversas guías clínicas, como la de la Sociedad Española de Nefrología [5] o la UK Renal Association recomendaran las dosis de al menos 35 ml/kg/h en pacientes con fallo renal agudo y síndrome de disfunción multiorgánica con un grado de evidencia alto. Sin embargo, a partir del 2008, las cosas parecen bien distintas.
Ensayo ATN
En julio de 2008 se publicó el ensayo ATN [7], en el que se incluyeron 1.124 pacientes, que se asignaron aleatoriamente a una estrategia intensiva o a una estrategia menos intensiva. Tanto en un brazo como en el otro, la modalidad de hemofiltración utilizada se ajustaba a la situación hemodinámica del paciente: en el caso de inestabilidad hemodinámica, se empleaban técnicas continuas (o híbridas) con una dosis típica de efluente de 35 ml/kg/h en el grupo de estrategia invasiva frente a 20 ml/kg/h en el grupo control; en el caso de pacientes estables, se aplicaban técnicas intermitentes con un Kt/V de 1,2 y una frecuencia de 6 dosis semanales en el grupo intensivo y de sólo 3 sesiones semanales en el grupo control. Pues bien, no hubo diferencias significativas e incluso la estrategia intensiva se asoció con una mortalidad a los 60 días ligeramente superior a la estrategia convencional.
Tabla II. Diseño del estudio ATN |
| |
Estrategia intensiva |
Estrategia no intensiva |
| Pacientes inestables |
HDFVVC 35 ml/kg/h |
HDFVVC 20 ml/kg/h |
| |
SLED diaria
|
SLED (3/semana) |
| Pacientes estables |
HDI (Kt/V 1,2; 6/semana) |
HDI (Kt/V 1,2; 3/semana) |
| |
Aunque se trata de un estudio de una gran calidad, el estudio ATN no ha estado libre de controversia [25-27]. Ello se debe en primer lugar al tipo de diseño utilizado, que no compara intervenciones simples sino estrategias complejas; por lo tanto, el diseño del ensayo no permite separar el impacto específico de la dosis y el de la modalidad empleada sobre los resultados observados. Si a esto asociamos la dificultad de comparar las dosis de técnicas continuas y discontinuas [28]; la limitada experiencia de algunos centros participantes en el ensayo [25]; y la baja tasa de recuperación de la función renal encontrada en el estudio [25, 27], se comprende que los resultados del ensayo son de difícil interpretación. Se han apuntado además otras dificultades, como la supuesta tardanza en el inicio de las técnicas de reemplazo renal [25, 29]. Sin embargo, estas críticas son asimismo aplicables a los estudios que han encontrado resultados positivos.
Otros estudios recientes
Desde mediados del año 2008 se han publicado 3 nuevos ensayos clínicos sobre las dosis altas en el fallo renal agudo. Si exceptuamos el pequeño estudio de Boussekey [30], con resultados inconcluyentes, los otros 2 ensayos proporcionan resultados consistentes con los del ensayo ATN.
Así, Tolwani y col [31] compararon hemofiltración a dosis altas (35 ml/kg/h) frente a convencionales (20 ml/kg/h), observando una mortalidad al alta de UCI o a los 30 días del 51% en el grupo experimental frente al 44% en el grupo tratado con dosis convencionales.
Más recientemente, el grupo de Hannover ha publicado los resultados de un ensayo [32] en el que los pacientes fueron tratados mediante una modalidad híbrida (diálisis extendida) a dosis estándar (para mantener unos niveles plasmáticos de urea entre 120-150 mg/dL) o intensificada (para mantener unos niveles plasmáticos de urea por debajo de 90 mg/dL), sin que se observara ninguna diferencia de mortalidad.
Además de estos ensayos clínicos, en el último año se han publicado nuevas evidencia frente a la supuesta interacción entre dosis altas y existencia de sepsis. Así, en el análisis de subgrupos del ensayo ATN [7], aunque no hubo interacción significativa, los resultados de la HFAV fueron peores en los pacientes con sepsis que en los pacientes sin sepsis.
Asimismo, acaban de ser publicados los resultados del estudio observacional DoReMI [33], en el que se analizaron los desenlaces clínicos de los pacientes con fallo renal agudo tratados con técnicas de reemplazo renal, en la práctica clínica real. Como se puede ver en la tabla III, nuevamente los resultados de la HFAV son peores en los pacientes con sepsis. Y además, el exceso de mortalidad de los pacientes con sepsis tratados con dosis altas aumenta al ajustar para las covariables mediante análisis multivariante.
Tabla III. Resultados estudio DOREMI |
| |
OR cruda (IC 95%) |
OR ajustada (IC 95%) |
| Sepsis |
1,64 (0,70-3,58) |
1,91 (0,71-5,13) |
| No sepsis |
1,27 (0,65-2,48) |
0,95 (0,43-2,10) |
| |
Causas de la heterogeneidad
Cuando se representan los resultados de los ensayos anteriores en un diagrama de árbol (figura 2), se observa una gran heterogeneidad estadística (I2 de 71%). Esta heterogeneidad desaconseja formalmente la realización de un meta-análisis (que sería como sumar peras con manzanas), y debería conducirnos a la pregunta de a qué se debe esta disparidad de resultados.
Figura 2. Ensayos clínicos hasta 2009 |
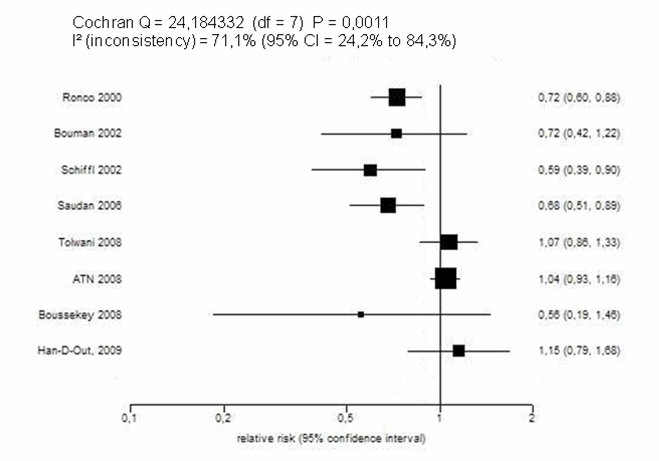
|
En la tabla IV, se compara el grupo de los ensayos favorables a la HFAV (los anteriores a 2008, sean o no significativos los resultados, más el pequeño estudio de Boussekey [30]).
Tabla IV. Características de los estudios con resultados positivos y negativos |
| Variable |
Resultado positivo (n=5) |
Resultado negativo (n=3) |
p |
RR |
0,69 (0,60-0,79) |
1,05 (0,96-1,16) |
< 0,001 |
Edad (años) |
62
|
59 |
0,1071 |
Peso (kg) |
70 |
84 |
0,1143 |
| Urea inicial (mg/dl) |
152 |
143 |
> 0,999 |
| Creatinina Inicial (mg/dl) |
4,10 |
3,25 |
0,4 |
| Prevalencia de sepsis |
30% (26-33%) |
63% (60-65%) |
<0,0001 |
| APACHE-II (media) |
24 |
27 |
0,2857 |
| Mortalidad Control |
56% (51-61%) |
51% (41-60%) |
0,3836 |
| Mortalidad experimental |
39% (35-44%) |
54% (45-63%) |
0,0017 |
| Potencia (RRR 20%) |
0,43 |
0,78 |
0,3929 |
| Indice de Jadad |
2,1 |
3,0 |
0,1429 |
| |
Algunos autores han sugerido que los resultados negativos del estudio ATN [7] podrían explicarse por un inicio demasiado tardío de la diálisis [25, 29]. Sin embargo, como se señala en la tabla IV, la creatinina y la urea iniciales ponderadas son iguales o mayores en los ensayos con resultados positivos, lo que contradice con esta hipótesis.
En segundo lugar, ya se ha comentado que, de acuerdo con las bases racionales de la HFAV, los pacientes que más se deberían beneficiar de las dosis altas son los pacientes con sepsis [16-20]. Sin embargo, lo que ocurre es justamente lo contrario: la prevalencia de sepsis (estimada mediante un meta-análisis de proporciones) es significativamente inferior en los ensayos con resultado positivo.
En tercer lugar, llama la atención que, a pesar de un menor APACHE inicial ponderado, la mortalidad del grupo control es ligeramente más alta en los ensayos con resultados positivos. En la figura 3 se comprueba que en los ensayos positivos la mortalidad observada del grupo control es mayor que la predicha por sus índices de gravedad, algo totalmente inusual en un ensayo clínico, en el que el grupo control es altamente seleccionado y suele tener una mortalidad menor que la esperada. Este patrón, junto con la baja potencia estadística de los ensayos con resultados favorables, sugiere fuertemente que los resultados positivos podrían no ser más que un “máximo aleatorio” [34, 35].
Figura 3. Exceso de mortalidad en el grupo control de los estudios con resultados positivos |
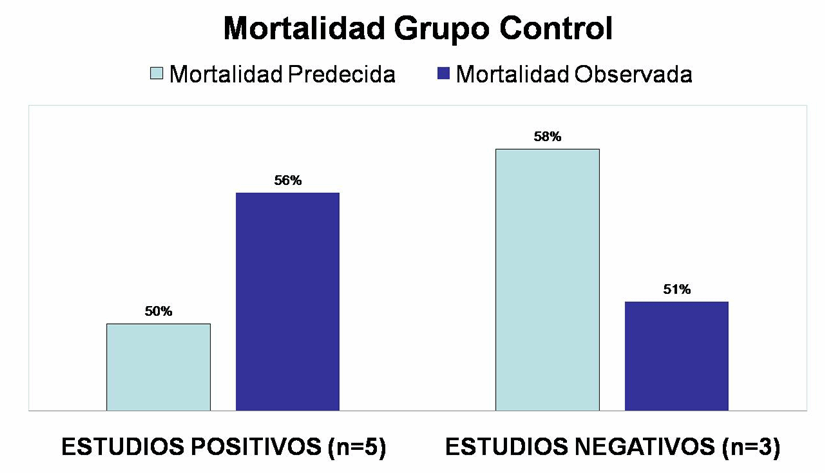
|
Por último, y quizá lo más importante, la calidad metodológica de los ensayos positivos es muy pobre, con un índice de Jadad promediado de 2.
Calidad de los estudios
El tema de la calidad de los estudios requiere un examen más detallado. En la tabla V se presentan los principales determinantes de la calidad de los ensayos, adaptada de los criterios de CASPe: (1) definición adecuada de la población a estudio, intervención y resultados; (2) ocultación de la secuencia de aleatorización; (3) pérdidas en el seguimiento de menos del 5%; (4) ausencia de disbalance clínicamente relevante entre los grupos experimental y control; (5) mortalidad en el grupo control cercana a la esperada por los índices de gravedad (dentro del ± 10%); (6) ausencia de subdosificación ; (7) poder estadístico superior al 50% para detectar una reducción relativa del riesgo del 20%. En la columna de la derecha se presenta el número de criterios de calidad que cumple cada estudio (a más puntuación, más calidad). De entrada es llamativo que los estudios con menor puntuación se corresponden con ensayos favorables a las dosis altas.
Tabla V. Calidad metodológica de los estudios |
Estudio |
PIO |
OSA |
Pérdidas > 15% |
Grupos |
Mortalidad control |
No subdosif. |
Poder > 50% |
Total |
| Ronco, 20004 |
0 |
0 |
1 |
0 |
0 |
1 |
1 |
3 |
| Bouman, 2002 |
1 |
0 |
1 |
0 |
1 |
1 |
0 |
4 |
| Schiffl, 2002 |
1 |
0 |
0 |
0 |
1 |
0 |
0 |
2 |
| Saudan, 2006 |
1 |
1 |
1 |
0 |
1 |
1 |
0 |
5 |
| Tolwani, 2008 |
1 |
1 |
1 |
0 |
1 |
0 |
0 |
4 |
| ATN, 2008 |
1 |
1 |
1 |
1 |
1 |
0 |
1 |
6 |
| Boussekey, 2008 |
1 |
0 |
0 |
0 |
1 |
1 |
0 |
3 |
| Han-D-Out, 2009 |
1 |
1 |
1 |
0 |
0 |
1 |
0 |
4 |
| |
Si examinamos más detenidamente esta tabla, vemos que los estudios con resultados positivos tienen serios problemas de validez:: población mal definida o con desenlaces clínicos inusuales [4, 23]; método de aleatorización no especificado [4, 22, 30] o inadecuado [23]; excesivas pérdidas post-aleatorización [23, 30]; grupos dudosamente balanceados (todos); exceso de mortalidad en el grupo control [4]; subdosificación en el grupo control [23]; estudios con resultado positivo sin potencia estadística- (todos menos el estudio de Ronco [4]). Las limitaciones afectan también a los ensayos con resultados negativos: Tolwani [31] (disbalanceado en ambos sentidos, infradosificación, bajo poder estadístico); ATN [7] (dosis altas en el grupo control, baja tasa de recuperación de función renal); Han-D-Out [32] (grupos disbalanceados, mortalidad menor de la esperada; bajo poder estadístico). Ningún estudio es doble ciego.
Por otro lado, destaca la gran heterogeneidad de pacientes, procedimientos y resultados. Los resultados hasta 2006 eran positivos y homogéneos, pero no se reproducen en los últimos ensayos (Han-D-Out [32], Tolwani [31], ATN [7]). Por tanto, gran parte de la heterogeneidad se explica por la calidad metodológica de los estudios (el índice de Jadad ponderado es menor en los ensayos con resultados positivos que en los ensayos negativos).
Si aplicamos un instrumento de medida del grado de evidencia como el GRADE [9], comprobamos que, a pesar de estar apoyada por ensayos clínicos, la evidencia de que la HFAV reduce la mortalidad en pacientes con fracaso renal agudo es de muy baja calidad, debido a las graves limitaciones de diseño (que le restarían 2 puntos) y la grave inconsistencia (que le restaría un punto adicional) (tabla VI).
Tabla 6. Grado de evidencia (escala GRADE) |
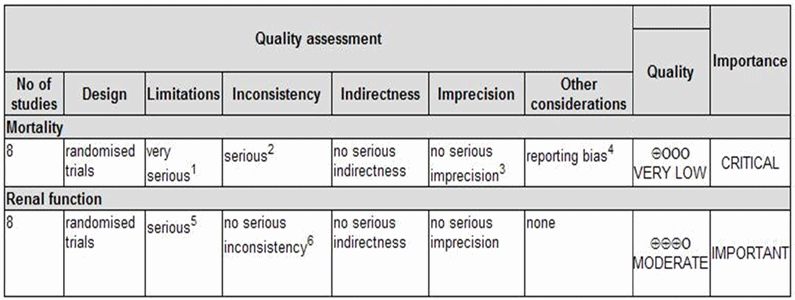
|
Otros desenlaces: recuperación de la función renal
La mayoría de los ensayos clínicos revisados [4, 7, 22-24, 30-32] proporcionan información sobre el grado de recuperación de la función renal en los grupos experimental y control. Estos resultados se representan en la figura 4. En este gráfico, los resultados a la derecha de la línea de no efecto irían a favor de la mejora de la función renal (favorece al grupo con HFAV), y los resultados a la izquierda en contra de la recuperación de la función renal (favorece al control).
Figura 4. Recuperación de la función renal |
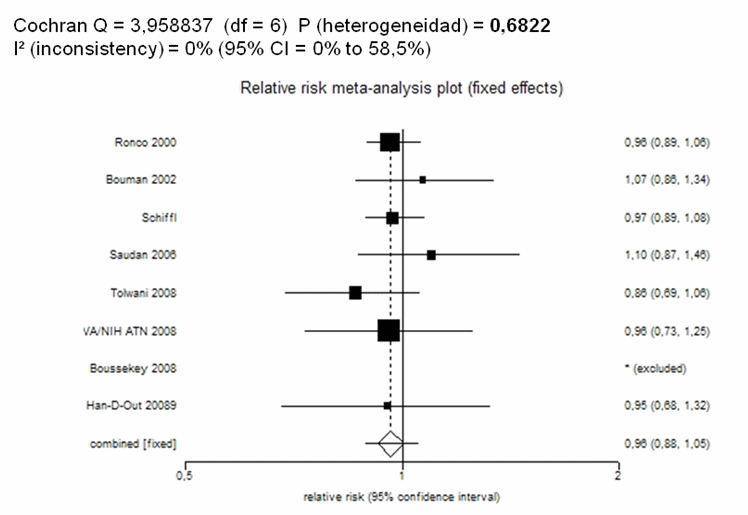
|
Es llamativo que, a pesar de la gran variedad de definiciones utilizadas para este desenlace clínico, los resultados sobre recuperación de la función renal son estadísticamente homogéneos (I2 0%). El riesgo relativo ponderado (0,96; IC 95% 0,88-1,05) indicaría en principio que las dosis altas en pacientes con fallo renal agudo no mejoran la recuperación de la función renal. Hay que resaltar, sin embargo, que el intervalo de confianza de 1 cola no cumple criterios de no-inferioridad, y por lo tanto, no se puede descartar que la HFAV sea deletérea para el riñón.
Si aplicamos el sistema GRADE (tabla VI) para valorar el grado de evidencia respecto a la recuperación de la función renal, diríamos que los datos sugieren que la HFAV no mejora la recuperación de la función renal e incluso son compatibles con un ligero empeoramiento. A diferencia de lo que ocurría con la mortalidad, aquí no se dan algunos de los problemas de validez, y además no existe heterogeneidad estadística. Por todo ello, asignamos un grado de evidencia BAJO.
Estudio RENAL
Para finalizar, recientemente se han presentado los resultados preliminares del largamente esperado ensayo RENAL (NCT00221013) [36, 37], el mayor ensayo realizado hasta ahora en pacientes con daño renal agudo (1.508 pacientes), en el que se comparaban dos dosis de HDFVVC de 25 frente a 40 ml/kg/h. Los resultados confirmaron plenamente los hallazgos del ensayo ATN. La mortalidad a los 90 días de los grupos experimental y control fue prácticamente idéntica (44,66 frente a 44,68%), y tampoco hubo diferencias en la duración de la estancia en UCI, la duración de la ventilación mecánica o la aparición de disfunción multiorgánica.
Recomendaciones finales
Una vez analizado el grado de evidencia, corresponde ahora valorar la relación riesgo/beneficio de las dosis altas teniendo en cuenta el grado de incertidumbre acerca de los efectos, la importancia de los desenlaces clínicos analizados y los riesgos, costes y cargas asociadas a cada una de las alternativas.
Consideramos demostrado que la evidencia de que la HFAV reduce la mortalidad en pacientes con fallo renal es extremadamente débil, e incluso hay indicios de que la HFAV pudiera ser perjudicial en los pacientes con sepsis. Asimismo, existe moderada evidencia de que las dosis altas no mejoran la recuperación de la función renal (cualquiera que sea la definición empleada) en pacientes con fallo renal agudo. Por consiguiente, y dado el aumento de la carga de trabajo y costes asociados, la recomendación de la HFAV en estos pacientes no está justificada, y los expertos responsables de la elaboración de guías de práctica clínica deberían plantearse una moratoria en su uso.
Las recomendaciones sobre el uso de las dosis altas en pacientes con sepsis grave sin fracaso renal o la posible utilidad de la HFAV intermitente (“pulsos”) en pacientes con síndrome de respuesta inflamatoria sistémica e inestabilidad hemodinámica quedan fuera del ámbito de la presente revisión.
Bibliografía
-
Palevsky PM. Clinical review: timing and dose of continuous renal replacement therapy in acute kidney injury. Crit Care 2007; 11: 232.
-
Pannu N, Klarenbach S, Wiebe N, Manns B, Tonelli M; Alberta Kidney Diease Network. Renal replacement therapy in patients with acute renal failure: a systematic review. JAMA 2008; 299: 793-805.
-
Leung AK, Yan WW. Renal replacement therapy in critically ill patients. Hong Kong Med J 2009; 15: 122-129.
-
Ronco C, Bellomo R, Homel P, et al. Effects of different doses in continuous veno-venous haemofiltration on outcomes of acute renal failure: a prospective randomised trial. Lancet 2000; 355: 26-30.
-
Gaínza FJ, Sánchez-Izquierdo JA. Indicaciones y aspectos logísticos de técnicas de depuración extracorpórea en el paciente agudo. Nefrología 2007; 27 (supl 3): 111-122.
-
Davenport A, Kanagasundaram S, Lewington A, Stevens P. Clinical practice guidelines. Module 5: Acute Kidney Injury. UK Renal Association. 4th Ed, 2008. [ www.renal.org/guidelines]
-
The VA/NIH Acute Renal Failure Trial Network. Intensity of renal support in critically ill patients with acute kidney injury. N Engl J Med 2008; 359: 7-20.
-
Centre for Reviews and Dissemination. Systematic Reviews. CRD’s guidance for undertaking reviews in health care. University of York, 2008.
-
Guyatt GH, Oxman AD, Vist G, Kunz R, Falck-Ytter Y, Alonso-Coello P, Schünemann HJ, for the GRADE Working Group. Rating quality of evidence and strength of recommendations GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ 2008; 336: 924-926.
-
Honoré PM, Joannes-Boyau O, Merson L, Boer W, Piette V, Galloy AC. The big bang of haemofiltration: the beginning of a new era in the third millennium for extra-corporeal blood purification. Inter J Artif Organs 2006; 29: 649-59.
-
Schulz KF, Chalmers I, Hayes RJ, et al. Empirical evidence of bias. Dimensions of methodological quality associated with estimates of treatment effects in controlled trials. JAMA 1995; 273: 408-412.
-
Jüni P, Altman DG, Egger M. Assessing the quality of controlled clinical trials. BMJ 2001; 323: 42-46.
-
Moher D, Jadad AR, Nichol G, Penman M, Tugwell P, Walsh S. Assessing the quality of randomized controlled trials: an annotated bibliography of scales and checklists. Controlled Clin Trials 1995; 16: 6273.
-
Altman DG, Bland JM. Interaction revisited: the difference between two estimates. BMJ 2003; 326: 219.
-
Freemantle N. Interpreting the results of secondary end points and subgroup analyses in clinical trials: should we lock the crazy aunt in the attic?. BMJ 2001; 322: 989-991.
-
Bellomo R, Baldwin I, Ronco C. High volume hemofiltration. Curr Opin Crit Care 2000; 6: 442-445.
-
Ronco C, Tetta C, Mariano F et al. Interpreting the mechanism of continuous renal replacement therapy in sepsis. The peak concentration hypothesis. Artif Organs 2003; 27: 792-801.
-
Honoré PM, Joannes-Boyau O. High volume hemofiltration (HVHF) in sepsis: a comprehensive review of rationale, clinical applicability, potential indications and recommendations for future research. Int J Artif Organs 2004; 27: 1077-1082.
-
Honoré PM, Joannes-Boyau O, Boer W, Collin V. High-Volume Hemofiltration in Sepsis and SIRS: Current Concepts and Future Prospects. Blood Purif 2009; 28: 1-11.
-
Joannes-Boyau O, Honoré PM, Boer W, Collin V. Are the synergistic effects of high-volume haemofiltration and enhanced adsorption the missing key in sepsis modulation? Nephrol Dial Transplant 2009; 24: 354-357.
-
Piccinni P, Ronco C. Early isovolemic hemofiltration in oliguric patients with septic shock [replica]. Intensive Care Med 2006; 32: 1098.
-
Bouman CS, Oudemans-van Straaten HM, Tijssen JG et al. Effects of early high-volume continuous venovenous hemofiltration on survival and recovery of renal function in intensive care patients with acute renal failure: a prospective, randomized trial. Crit Care Med 2002; 30: 2205-2211.
-
Schiffl H, Lang SM, Fischer R. Daily hemodialysis and the outcome of acute renal failure. N Engl J Med 2002; 346: 305-310.
-
Saudan P, Niederberger M, De Seigneux S et al. Adding a dialysis dose to continuous hemofiltration increases survival in patients with acute renal failure. Kidney Int 2006; 70: 1312-1317.
-
Ronco C, Cruz D, Oudemans van Straaten H, Honoré P, House A, Bin D, Gibney N. Dialysis dose in acute kidney injury: no time for therapeutic nihilism – a critical appraisal of the Acute Renal Failure Trial Network study. Crit Care 2008; 12: 308.
-
Maynar-Moliner J, Sánchez-Izquierdo-Riera JA, Herrera-Gutierrez M. Renal support in critically ill patients with acute kidney injury [carta]. N Engl J Med 2008; 359: 1960.
-
Uchino S, Bell M, Bellomo R. Renal support in critically ill patients with acute kidney injury [carta]. N Engl J Med 2008; 359: 7-20.
-
Clark WR, Turk JE, Kraus MA, Gao D. Dose determinants in continuous renal replacement therapy. Artif Organs. 2003; 27: 815-20
-
Maynar-Moliner J, Sánchez-Izquierdo Riera JA, Herrera Gutiérrez M. Dosis de diálisis en la insuficiencia renal aguda. [ REMI 2008; 8 (11): A92]
-
Boussekey N, Chiche A, Faure K, Devos P, Guery B, d'Escrivan T, Georges H, Leroy O. A pilot randomized study comparing high and low volume hemofiltration on vasopressor use in septic shock. Intensive Care Med 2008; 34: 1646-1653.
-
Tolwani AJ, Campbell RC, Stofan BS, Lai KR, Oster RA, Wille KM. Standard versus high-dose CVVHDF for ICU-related acute renal failure. J Am Soc Nephrol 2008; 19: 1233-1238.
-
Faulhaber-Walter R, Hafer C, Jahr N, Vahlbruch J, Hoy L, Haller H, Fliser D, Kielstein JT. The Hannover Dialysis Outcome study: comparison of standard versus intensified extended dialysis for treatment of patients with acute kidney injury in the intensive care unit. Nephrol Dial Transplant 2009 doi: 10.1093/ndt/gfp035.
-
Vesconi S, Cruz DN, Fumagalli R, Kindgen-Milles D, Monti G, Marinho A, Mariano F, Formica M, Marchesi M, René R, Livigni S, Ronco C; DOse REsponse Multicentre International collaborative Initiative (DO-RE-MI Study Group). Delivered dose of renal replacement therapy and mortality in critically ill patients with acute kidney injury. Crit Care 2009; 13: R57.
-
Montori VM, Devereaux PJ, Adhikari NK, Burns KE, Eggert CH, Briel M, et al. Randomized trials stopped early for benefit: a systematic review. JAMA 2005; 294: 2203-2209.
-
Latour-Pérez J, Cabello-López J. Interrupción precoz de los ensayos clínicos. ¿Demasiado bueno para ser cierto? Med Intensiva 2007; 31: 518-520.
-
-
Jaime Latour Pérez.
Servicio de Medicina Intensiva,
Hospital General Universitario de Elche
Miguel Ángel García García.
Servicio de Medicina Intensiva,
Hospital de Sagunt
©REMI, http://remi.uninet.edu. Junio 2009.
Palabras clave:
Fracaso renal agudo, Hemofiltración de alto volumen, Tratamiento.
|
|