|
Manejo de la hemorragia por varices
esofágicas en UCI
I: Tratamiento farmacológico y endoscópico
Introducción
El objetivo principal de
esta revisión es realizar una puesta al día sobre el estado del arte en
la hemorragia por varices. Aunque en muchos hospitales terciarios existen
Unidades de sangrantes dirigidas por gastroenterólogos, en la mayoría de
centros todavía los médicos intensivistas somos los responsables del
manejo de estos enfermos.
En la gran mayoría de los
casos se controlará el sangrado mediante endoscopia. No obstante, cuando
el tratamiento inicial falla las decisiones en estos enfermos no son fáciles
y son objeto de polémica. Discutiremos primero las modalidades del
tratamiento con un mayor impacto en las decisiones del intensivista.
Posteriormente se propondrán algunos principios generales de manejo. No
se discutirán aquí la profilaxis primaria ni secundaria del sangrado por
varices por ser un tema específico del gastroenterólogo.
Las varices esofágicas
constituyen un problema de salud importante. Hasta un 20% de los pacientes
cirróticos desarrollará varices a lo largo de su enfermedad (1, 2). La
prevalencia de esta patología se encuentra en torno al 13% en los
primeros cinco años. El riesgo de sangrado se asocia significativamente
al daño hepático, el tamaño de la variz
y la presión en su interior, pudiendo estimarse que cerca del 30%
de pacientes sangrarán en un plazo de dos años (3). La mortalidad media
de este proceso es del 50 % y depende fundamentalmente del grado funcional
según la escala de Child (5% en clase A, 25% en B y 50% en C) (4).
El tratamiento ideal de la
hemorragia por varices debería reunir cuatro características básicas:
eficaz, seguro, fácil de administrar y barato. Las opciones del
tratamiento actuales incluyen medicaciones (vasopresina,
somatostatina y sus análogos), técnicas endoscópicas, cirugía,
y la implantación de sistemas de derivación intrahepática insertados
por vía yugular (TIPS) Ninguna de estas modalidades terapéuticas es por
sí sola idónea. La elección en cada caso dependerá de la decisión del
médico basada en criterios de eficacia relativa, familiaridad con cada técnica,
seguridad, y coste (5).
Definiciones terminológicas
Es conveniente definir
previamente algunos términos.
Hemorragia por varices:
Sangrado de una variz esofágica o gástrica en el momento de realizar la
endoscopia, presentando sangre en estómago y en ausencia de otra lesión
sangrante (6).
Este episodio es clínicamente importante cuando:
-
Existe necesidad de transfundir dos o más
concentrados de hematíes en las primeras 24 horas de ingreso.
-
La tensión arterial sistólica es menor de 100 mm Hg, o se aprecia
disminución postural de 20 mm Hg.
-
Frecuencia cardiaca por encima de 100 latidos por
minuto.
Resangrado: Aparición de un nuevo episodio de
hematemesis o melena tras 24 horas de estabilización clínica y analítica
(el período de sangrado agudo comprende las primeras 48 horas de
ingreso), sin importar la
gravedad clínica (6).
Fallo terapéutico: Se consideran dos escenarios
en este concepto (6):
-
Fallo en las primeras seis horas de sangrado.
Definido por la presencia de
cualquiera de estas dos condiciones.
-
Necesidad de transfundir cuatro o más concentrados
de hematíes para conseguir un aumento de tensión arterial sistólica
superior a 20 mm Hg o una tensión arterial sistólica superior a 70
mm Hg.
-
Imposibilidad de lograr reducir el pulso por debajo
de 100 lpm o disminuirlo en 20 lpm.
-
Fallo en
las seis horas siguientes. Definido por cualquiera de las
siguientes condiciones:
-
Presencia de hematemesis o melena.
-
Reducción en la tensión arterial sistólica de más de 20 mm Hg. tras
las primeras seis horas, o incremento del pulso en más de 20 lpm en
dos tomas de constantes horarias sucesivas.
-
Transfusión de dos concentrados de hematíes para
alcanzar un hematocrito del 27% o una hemoglobina de 9 gr/dl.
Mortalidad precoz: La que se produce en las seis
semanas siguientes al episodio de sangrado.
Tratamiento farmacológico
Vasopresina y análogos
La vasopresina intravenosa
(0,4 U en bolo seguido por 0,4 a 1,0 U/min como una infusión) constriñe
las arteriolas de la circulación portal y mesentérica, disminuyendo así
el flujo venoso (7). Varios estudios han evaluado el papel de la
vasopresina en el manejo de la hemorragia activa. La vasopresina puede
lograr una tasa de hemostasia inicial del 60 al 80%, pero tiene sólo
efectos marginales en los episodios de resangrado, sin mejoría clara
sobre la supervivencia (7). Además, el cese del sangrado puede verse
contrarestado por un aumento de la mortalidad debida a isquemia cerebral,
intestinal y miocárdica. Asimismo, su acción hipotensora parece
atenuarse tras la hemorragia aguda (7). Estas consideraciones, más el
mayor beneficio encontrado con somatostatina o sus análogos, han reducido
el uso de vasopresina en la hemorragia por varices.
El uso de nitratos
(nitroglicerina) se recomendó para evitar los efectos adversos
relacionados con la vasoconstricción por vasopresina. La nitroglicerina
es un potente vasodilatador coronario y sistémico. Cuando se usa junto
con vasopresina, acentúa sus efectos en la circulación portal, con
reversión de sus efectos sistémicos (8).
Basados en estos datos, se
recomienda el uso combinado de vasopresina y nitroglicerina intravenosas
(10 a 50 µg/min), dado que la vía transdérmica puede no ser tan eficaz
(9). El terlipresin es un análogo de vasopresina de liberación lenta y
con acción sostenida en el músculo liso arteriolar. Parece similar en su
eficacia a la somatostatina y superior al placebo (10), con una reducción
del riesgo relativo de mortalidad del 33% frente a otras terapias farmacológicas
(vasopresina y somatostatina) (11).
Somatostatina y sus análogos
La Somatostatina inhibe la
liberación de hormonas con acción vasodilatadora, como el glucagon (12),
causando indirectamente vasoconstricción del flujo esplácnico y portal.
Tiene una vida media muy corta y se metaboliza
en minutos tras infusión en bolo; el octreotido es un análogo de
somatostatina con mayor vida media. La infusión de un bolo de
somatostatina u octreotido disminuye en segundos el flujo venoso en la
porta, en la azigos, así como las presiones portal e intravariz.
Ensayos clínicos
Varios ensayos clínicos han
comparado somatostatina u octreotido con
vasopresina o placebo en el manejo del sangrado activo. Un estudio
inicial frente a placebo no demostró beneficio con somatostatina;
sin embargo, más del 80 por ciento de pacientes tratados con placebo
dejaron de sangrar espontáneamente, lo que pudo haber enmascarado el
efecto del fármaco (13). La somatostatina es significativamente superior
al placebo con respecto al logro de la hemostasia y a la prevención del
resangrado precoz.
a) Somatostatina frente a
vasopresina
Somatostatina también es
superior a la vasopresina y al taponamiento con balón debido en parte a
la práctica ausencia de efectos colaterales. Un metaanálisis de ensayos
que compararon somatostatina y vasopresina encontraron dos beneficios en
el uso de la somatostatina (14):
-
Un mayor
riesgo relativo (1,62) de controlar el sangrado.
-
Un riesgo más bajo de
efectos adversos (0 contra 10% con
vasopresina).
Sin embargo, y a pesar de
estos efectos beneficiosos, no se mejoró la supervivencia.
b) Somatostatina frente a
escleroterapia.
La somatostatina también se
ha comparado con la escleroterapia endoscópica. En un estudio se
aleatorizaron 70 pacientes que estaban sangrando activamente para recibir
somatostatina o escleroterapia (15). El control inicial del sangrado (80
contra 83%), la tasa de resangrado precoz (25 contra 17%), y la mortalidad
(29 contra 23%) fueron similares entre los dos grupos. Se demostró una
eficacia similar para el octreotido en dos ensayos que incluyeron 176
pacientes (16, 17).
c) Somatostatina más
escleroterapia-
El tratamiento con
somatostatina u octreotido, junto con escleroterapia es superior a cada
terapéutica por separado para la prevención del sangrado precoz, y
posiblemente para mejorar la supervivencia (18, 19, 20). En un ensayo se
trataron 199 pacientes con escleroterapia, siendo asignados posteriormente
de manera aleatoria a recibir una infusión intravenosa de octreotido (25
µg/h durante cinco días) o de placebo (19). La supervivencia sin
resangrado a cinco días era significativamente más alta con el
octreotido (87 contra 71%) pero no había ninguna diferencia en la
supervivencia acumulada en 15 días (88% en ambos grupos).
En un estudio con 262
pacientes, la adición de octreotido (100 µg hipodérmicamente tres veces
al día durante 15 días) se asoció a un menor resangrado en pacientes
tratados con escleroterapia y betabloqueantes (16 contra 26%) (20). La
mortalidad no fue diferente. Sin embargo, otro estudio con mayor muestra
no encontró beneficio
adicional cuando el octreotido se agregó a la escleroterapia (21).
Un tercer estudio comparando
somatostatina sola frente a somatostatina más escleroterapia en 100
pacientes sangrantes mostró que la terapia combinada era superior en el
control del sangrado (92 contra 76%) y la prevención del resangrado
precoz (93 contra 76%) (22). En el análisis multivariante la presencia de
shock en la admisión, junto con sangrado activo durante la escleroterapia,
estaba asociada a fracaso de la somatostatina como monoterapia.
d) Somatostatina más ligadura endoscópica de varices
Un estudio incluyó 184
pacientes con sangrado activo, que fueron asignados al azar a recibir un
análogo de la somatostatina (vapreotide) o
placebo seguido a las 12 horas de terapia endoscópica (ligadura o
escleroterapia o infusión con cianoacrilato
para varices gástricas) (23). La terapia combinada estuvo asociada
a mayor supervivencia y
control del sangrado a los cinco días (66 contra 55%). La mortalidad
global a 42 días fue similar.
En el resumen, la
somatostatina (250 bolo de µg seguido por 250 µg/h por la infusión
intravenosa durante cinco días) es más eficaz en el control del sangrado
y tiene menos efectos colaterales que la vasopresina (14). Por tanto, la
somatostatina ha reemplazado a la vasopresina como tratamiento del
sangrado activo por varices.
En cuanto al octreotido (50
µg en bolo seguido por 50 µg/h en infusión intravenosa durante
cinco días) dos recientes metaanálisis han establecido su utilidad. En
uno de ellos, el fármaco disminuyó la probabilidad de resangrado con
respecto a otras terapias farmacológicas (RR= 0,63; IC 95% 0,55-0,77) y
con similar efecto que la escleroterapia, mostrando un excelente perfil de
seguridad (24). En otra revisión sistemática los resultados mostraron
que este fármaco constituye una adecuada terapia coadyuvante a las técnicas
endoscópicas (25).
Existe, pues, una sólida
evidencia de que la terapia médica debería combinarse con el tratamiento
endoscópico para conseguir una adecuada reversión del sangrado. No
obstante, ninguno de estos fármacos mejora la mortalidad (26, 27).
Tratamiento endoscópico
La terapia endoscópica es
actualmente el tratamiento definitivo para el sangrado activo por varices
(27, 28). Puede realizarse a pie de cama, una vez realizado el diagnóstico.
Se han estudiado dos formas de tratamiento endoscópico: la escleroterapia
y la ligadura.
-
La escleroterapia
consiste en la inyección de una solución esclerosante en las
varices. Se dispone de varias soluciones esclerosantes (polidocanol o
tetradecil sulfato), sin que ninguna sea claramente superior a la
otra. El volumen y frecuencia de inyecciones también varían
ampliamente.
-
La ligadura es similar a
la realizada en el plexo hemorroidal: se colocan bandas elásticas
pequeñas alrededor de las varices en los últimos 5 centímetros del
esófago (Figura 1).
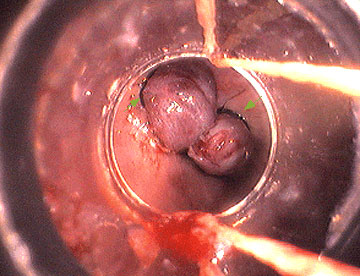
Fig 1. Ligadura de
varices esofágicas. La endoscopia muestra dos varices en esófago distal
que han sido ligadas. Las flechas verdes indican la situación de las
bandas.
Los ensayos clínicos-
Las varices gástricas y gastroesofágicas tipo I y II pueden tratarse con
ambas técnicas. Las varices gástricas aisladas no pueden abordarse con
estas técnicas de manera habitual.
La escleroterapia parece
superior tanto al neumotaponamiento y
vasopresina aislados, como a una combinación de las mismas para el
control de la hemorragia activa, prevención del resangrado precoz y mejoría
de la supervivencia en pacientes con varices esofágicas y gastroesofágicas.
La inyección intravariceal o paravariceal parecen de similar eficacia. La
ultrasonografía endoscópica puede ayudar a una mejor localización de la
variz y de su tratamiento (29).
Como se ha reseñado
anteriormente, la somatostatina o el octreotido son tan eficaces como la
escleroterapia para detener el sangrado agudo (15), pero la terapia
combinada es más eficaz que las técnicas endoscópicas aisladas (17, 18,
19).
La ligadura es al menos tan
eficaz como la escleroterapia para lograr la hemostasia (86% contra 77%) y
la prevención del resangrado precoz (30). Un metaanálisis encontró que,
comparada con la escleroterapia, la ligadura redujo el riesgo de
resangrado (OR 0,52), la tasa de mortalidad (OR 0,67), la tasa de muerte
por sangrado (OR 0,49), y la incidencia de complicaciones (31). Cuatro
pacientes necesitarían ser tratados con ligadura en lugar de
escleroterapia para evitar un resangrado y 10 para prevenir una muerte. No
obstante, la tasa de recurrencia de las varices es alta (29).
Mientras los ensayos clínicos
indican una ventaja de la ligadura sobre la escleroterapia a largo plazo,
la experiencia de algunos especialistas es que las bandas disminuyen el
campo de visión y la maniobrabilidad del endoscopio. Sin embargo, la
escleroterapia podría tener un efecto negativo sobre la motilidad esofágica
y el reflujo respecto a la ligadura (32). Así, ambos procedimientos son
opciones razonables para la hemorragia activa, y la elección de una u
otra depende de la experiencia y preferencia de cada endoscopista. Tampoco
la terapia combinada con las dos técnicas parece ofrecer mayor beneficio
que la ligadura (33).
Las complicaciones
Las complicaciones de la escleroterapia pueden
clasificarse como locales, regionales y sistémicas (33, 34):
-
Complicaciones locales son: ulceración, sangrado,
trastornos motores, estenosis y gastropatía hipertensiva portal.
-
Complicaciones regionales son: perforación
esofágica y mediastinitis.
-
Complicaciones sistémicas son: sepsis, aspiración
e hipoxemia.
Todas estas complicaciones ocurren más frecuentemente
en procedimientos de urgencia. En un ensayo controlado, la proporción de
complicaciones era significativamente más baja con ligadura que con
escleroterapia (2 contra 22%) (28). En un metaanálisis, la ligadura tuvo
una proporción más baja de estenosis con respecto a la escleroterapia
(29). Por estas razones, puede ser más conveniente realizar la
escleroterapia en fase aguda y la ligadura en una o dos semanas. Sin
embargo, puede realizarse ligadura directa si el endoscopista lo juzga
factible.
Ambas técnicas pueden aumentar el riesgo de
desarrollar gastropatía hipertensiva portal (31, 34, 35). En una
revisión prospectiva, 107 pacientes con hipertensión portal por varias
causas se estudiaron antes y después de la escleroterapia (35). La
gastropatía era evidente en 4 de 35 pacientes con cirrosis y en ninguno
de los no cirróticos. Tras la escleroterapia, 21 pacientes más (20%)
desarrollaron gastropatía durante un seguimiento de 23 meses.
Bibliografía:
-
Pascal
JP. [The natural history of digestive hemorrhage in patients with
cirrhosis]. Gastroenterol Clin Biol 1990; 14(1 ( Pt 2)):7B-11B.
-
Yang
WL, Tripathi D, Therapondos G. Endoscopic use of human thrombin in
bleeding gastric varices. Am J Gastroenterol 2002; 97:1381.
-
Bendtsen
F, Becker PU. [Treatment of esophageal varices]. Ugeskr Laeger 2001;
163(11):1552-1556.
-
Prediction
of the first variceal hemorrhage in patients with cirrhosis of the
liver and esophageal varices. A prospective multicenter study. The
North Italian Endoscopic Club for the Study and Treatment of
Esophageal Varices. N Engl J Med 1988; 319(15):983-989.
-
Sanyal
AJ. Treatment of active variceal hemorrhage.
In: UpToDate, Rose, BD (Ed),
UpToDate, Wellesley, MA, 2002.
-
Jalan
R, Hayes PC. UK guidelines on the management of variceal haemorrhage
in cirrhotic patients. British Society of Gastroenterology. Gut 2000;
46 Suppl 3-4:III1-III15.
-
Blei
AT, Groszmann RJ. Vasopressin and vasoconstrictors. In: Shepherd AP,
Granger DN, editors. Physiology of the Intestinal Microcirculation.
New York: Raven Press, 1984: 377.
-
Tsai
YT, Lay CS, Lai KH, Ng WW, Yeh YS, Wang JY et al. Controlled trial of
vasopressin plus nitroglycerin vs. vasopressin alone in the treatment
of bleeding esophageal varices. Hepatology 1986; 6(3):406-409.
-
Bosch
J, Groszmann RJ, Garcia-Pagan JC, Teres J, Garcia-Tsao G, Navasa M et
al. Association of
transdermal nitroglycerin to vasopressin infusion in the treatment of
variceal hemorrhage: a placebo-controlled clinical trial. Hepatology
1989; 10:962.
-
Escorsell
A, Ruiz dA, Planas R, Albillos A, Banares R, Cales P et al. Multicenter
randomized controlled trial of terlipressin versus sclerotherapy in
the treatment of acute variceal bleeding: the TEST study. Hepatology
2000; 32(3):471-476.
-
Ioannou
G, Doust J, Rockey DC. Terlipressin for acute esophageal variceal
hemorrhage. Cochrane Database Syst Rev 2001;(1):CD002147.
-
Bloom
SR, Polak JM. Somatostatin. Br Med J (Clin Res Ed) 1987;(295):28813
Valenzuela JE, Schubert T, Fogel MR, Strong RM, Levine J, Mills
PR et al. A multicenter, randomized, double-blind trial of
somatostatin in the management of acute hemorrhage from esophageal
varices. Hepatology 1989; 10(6):958-961.
-
-
Imperiale
TF, Teran JC, McCullough AJ. A meta-analysis of somatostatin versus
vasopressin in the management of acute esophageal variceal hemorrhage.
Gastroenterology 1995; 109(4):1289-1294.
-
Planas
R, Quer JC, Boix J, Canet J, Armengol M, Cabre E et al. A
prospective randomized trial comparing somatostatin and sclerotherapy
in the treatment of acute variceal bleeding. Hepatology 1994;
20(2):370-375.
-
Bildozola
M, Kravetz D, Argonz J, Romero G, Suarez A, Jmelnitzky A et al. Efficacy
of octreotide and sclerotherapy in the treatment of acute variceal
bleeding in cirrhotic patients. A prospective, multicentric, and
randomized clinical trial. Scand J Gastroenterol 2000; 35(4):419-425.
-
Sung
JJ, Chung SC, Yung MY, Lai CW, Lau JY, Lee YT et al. Prospective
randomised study of effect of octreotide on rebleeding from
oesophageal varices after endoscopic ligation. Lancet 1995;
346(8991-8992):1666-1669.
-
Avgerinos
A, Nevens F, Raptis S, Fevery J. Early administration of somatostatin
and efficacy of sclerotherapy in acute oesophageal variceal bleeds:
the European Acute Bleeding Oesophageal Variceal Episodes (ABOVE)
randomised trial. Lancet 1997; 350(9090):1495-1499.
-
Besson
I, Ingrand P, Person B, Boutroux D, Heresbach D, Bernard P et al.
Sclerotherapy with or without octreotide for acute variceal bleeding.
N Engl J Med 1995; 333(9):555-560.
-
D'Amico
G, Politi F, Morabito A, D'Antoni A, Guerrera D, Giannuoli G et al. Octreotide
compared with placebo in a treatment strategy for early rebleeding in
cirrhosis. A double blind, randomized pragmatic trial. Hepatology
1998; 28(5):1206-1214.
-
Primignani
M, Andreoni B, Carpinelli L, Capria A, Rocchi G, Lorenzini I et al.
Sclerotherapy plus octreotide versus sclerotherapy alone in the
prevention of early rebleeding from esophageal varices: a randomized,
double-blind, placebo-controlled, multicenter trial. New
Italian Endoscopic Club. Hepatology 1995; 21(5):1322-1327.
-
Villanueva
C, Ortiz J, Sabat M, Gallego A, Torras X, Soriano G et al. Somatostatin
alone or combined with emergency sclerotherapy in the treatment of
acute esophageal variceal bleeding: a prospective randomized trial.
Hepatology 1999; 30(2):384-389.
-
Cales
P, Masliah C, Bernard B, Garnier PP, Silvain C, Szostak-Talbodec N et
al. Early administration of vapreotide for variceal bleeding in
patients with cirrhosis. French Club for the Study of Portal
Hypertension. N Engl J Med 2001; 344(1):23-28.
-
Corley
DA, Cello JP, Adkisson W, Ko WF, Kerlikowske K. Octreotide for acute
esophageal variceal bleeding: a meta-analysis. Gastroenterology 2001;
120(4):946-954.
-
Erstad
BL. Octreotide for acute variceal bleeding. Ann Pharmacother 2001;
35(5):618-626.
-
Gotzsche
PC. Somatostatin or octreotide for acute bleeding oesophageal varices.
Cochrane Database Syst Rev 2000;(2):CD000193.
-
Banares
R, Albillos A, Rincon D, Alonso S, Gonzalez M, Ruiz-del-Arbol L et al.
Endoscopic
treatment versus endoscopic plus pharmacologic treatment for acute
variceal bleeding: a meta-analysis. Hepatology 2002; 35(3):609-615.
-
Grace
ND. Diagnosis and treatment of gastrointestinal bleeding secondary to
portal hypertension. American College of Gastroenterology Practice
Parameters Committee. Am J Gastroenterol 1997; 92(7):1081-1091.
-
Seewald
S, Seitz U, Yang AM, Soehendra N. Variceal bleeding and portal
hypertension: still a therapeutic challenge? Endoscopy 2001;
33(2):126-139.
-
Stiegmann
GV, Goff JS, Michaletz-Onody PA, Korula J, Lieberman D, Saeed ZA et
al. Endoscopic sclerotherapy as compared with endoscopic ligation for
bleeding esophageal varices. N Engl J Med 1992; 326(23):1527-1532.
-
Laine
L, Cook D. Endoscopic ligation compared with sclerotherapy for
treatment of esophageal variceal bleeding. A meta-analysis. Ann Intern
Med 1995; 123(4):280-287.
-
Viazis
N, Armonis A, Vlachogiannakos J, Rekoumis G, Stefanidis G,
Papadimitriou N et al. Effects of endoscopic variceal treatment on
oesophageal function: a prospective, randomized study. Eur J
Gastroenterol Hepatol 2002; 14(3):263-269.
-
Saeed
ZA, Stiegmann GV, Ramirez FC, Reveille RM, Goff JS, Hepps KS et al.
Endoscopic variceal ligation is superior to combined ligation and
sclerotherapy for esophageal varices: a multicenter prospective
randomized trial. Hepatology 1997; 25(1):71-74.
-
D'Amico
G, Pagliaro L, Bosch J. The treatment of portal hypertension: a meta-analytic
review. Hepatology 1995; 22(1):332-354.
-
Fort
E, Sautereau D, Silvain C, Ingrand P, Pillegand B, Beauchant M. A
randomized trial of terlipressin plus nitroglycerin vs. balloon
tamponade in the control of acute variceal hemorrhage. Hepatology
1990; 11(4):678-681.
Vicente Gómez Tello
Servicio de Medicina Intensiva
Clínica Moncloa, Madrid
©REMI, http://remi.uninet.edu.
Enero 2003.
Ir
a la cabecera de la página
Envía tu comentario
para su publicación |