|
Manejo de la hemorragia por varices esofágicas
en UCI
II: Fallo del tratamiento endoscópico. Recomendaciones.
Varices gástricas
Fallo del tratamiento endoscópico. La
hemorragia grave
El tratamiento endoscópico
urgente no controla el sangrado en un 10 a 20 por ciento de los casos.
Estos enfermos presentan un riesgo elevado de muerte. La mayoría de los
pacientes ya ha recibido tratamiento farmacológico previo a la
endoscopia. En esta situación, se puede realizar un segundo intento
endoscópico de hemostasia (ligadura si la escleroterapia fallado) Sin
embargo, si el sangrado no se puede controlar rápida y eficazmente se
debe recurrir al taponamiento neumático o a algún tipo de derivación
portosistémica.
Neumotaponamiento.
El balón es una manera
eficaz de lograr la hemostasia a corto plazo. Se han usado tres tipos de
dispositivos: las sondas de Sengstaken-Blakemore tienen un globo gástrico
de 250 ml, un globo esofágico y un puerto de succión gástrica), la
sonda de Minnesota (un Sengstaken-Blakemore modificado con un puerto de
succión por encima del balón esofágico), y la sonda de Linton-Nachlas
(qué tiene un sólo balón gástrico de 600 cc) (34).
El control inicial del
sangrado por varices con estos dispositivos es de un 30 a un 90 por ciento
en varios estudios (35). Ello depende de la selección de
pacientes, el uso concomitante de otros tipos de terapia, y la experiencia
personal. No obstante, hasta un 50% de pacientes sangran cuando se
desinfla el balón. El neumotaponamiento parece ser menos eficaz en
pacientes en los que fallan los fármacos y en aquellos con resangrado
precoz.
Además, el
neumotaponamiento se asocia con complicaciones significativas; la más
letal de ellas es la rotura esofágica. Se han observado complicaciones
mayores en aproximadamente 14 por ciento de pacientes, siendo esta cifra
mayor cuando los operadores eran relativamente inexpertos en la técnica.
Los balones deben usarse cautamente en pacientes con fracaso respiratorio,
arritmias cardíacas, y hernia hiatal (36). La vía aérea debe
protegerse en todas las pacientes que reciben este tratamiento debido a la
dificultad en el manejo de secreciones y el riesgo consiguiente para la
aspiración.
Debido a las consideraciones
anteriores, el único papel de este tratamiento es estabilizar al paciente
temporalmente –unas 48 horas- para que pueda instaurarse una terapia
definitiva.
Técnicas quirúrgicas.
Existe una gran cantidad de
literatura sobre el papel de la cirugía en el control del sangrado por
varices. Hay dos tipos básicos de técnicas: las que realizan shunt y las
que no lo realizan. Las técnicas con shunt pueden clasificarse como:
-
No selectivas: descomprimen el árbol portal entero y desvían
todo el flujo fuera del sistema portal. Son las clásicas derivaciones
portocava.
-
Selectivas: descomprimen el llenado de varices respetando la
perfusión hepática. Son los shunts espleno-renales distales.
-
Parciales: descomprimen incompletamente el árbol portal y por
eso también mantienen un cierto grado de perfusión hepática.
Las técnicas sin shunt
generalmente incluyen cualquier transección del esófago (en que el esófago del distal es cortado y vuelto a
suturar con grapas) o devascularización
de la unión gastroesofágica (el procedimiento de Sugiura).
Los datos son difíciles de
combinar debido a la heterogeneidad de pacientes estudiados, técnicas
aplicadas y protocolos distintos de manejo no quirúrgico. Sin embargo,
pueden extraerse algunas conclusiones generales:
-
La cirugía descompresiva y la transección son muy eficaces
para lograr la hemostasia.
-
Las derivaciones portocava de urgencia se trombosan más que
las electivas. Además, estas derivaciones alteran la anatomía vascular,
complican un futuro transplante hepático y se asocian a un 40 a 50% de
incidencia de encefalopatía. Puesto que la escleroterapia urgente es tan
eficaz como el shunt portocava para controlar el sangrado (37),
las complicaciones asociadas con la cirugía han llevado a que estas técnicas
tengan un lento declive en su uso como tratamiento de primera línea. No
obstante, la descompresión portal quirúrgica sigue siendo una manera
eficaz de parar la hemorragia y prevenir el resangrado en enfermos donde
las técnicas endoscópicas fallan. En manos experimentadas, las
derivaciones portocava selectivas son también eficaces también para
controlar la hemorragia. Pero sólo en escasos centros existe la
suficiente experiencia como para garantizar el éxito con este tipo de
intervención.
La transección esofágica
es tan eficaz como la escleroterapia (37, 38). Sin embargo, pueden
observarse sangrados en la línea de sutura y recurrir las varices, ya que
no se trata la hipertensión portal. Por ello no se realiza
rutinariamente. El procedimiento de Sugiura puede usarse en pacientes que
no son candidatos a shunt portocava, como aquéllos con trombosis de la
porta extendida hacia las
ramas esplénica y mesentérica superior (39).
TIPS
Los stents intrahepáticos
insertados por vía yugular (TIPS) se realizan pasando un catéter con
aguja (catéter de Colapinto) por vía transyugular y enclavándolo en la
vena hepática. Se saca la aguja y se le hace avanzar a través del parénquima
hepático. El TIPS funciona así como un shunt latero-lateral sin requerir
anestesia general o cirugía mayor.
En los estudios iniciales se
logró la hemostasia en la inmensa mayoría de pacientes con fallo
endoscópico (40, 41). La técnica podía realizarse en un período razonable
de tiempo en la mayoría de los pacientes con una baja morbi-mortalidad en
el procedimiento. Sin embargo, la eficacia del TIPS presentaba un probable
sesgo debido a la heterogénea población tratada y a una incorrecta
definición de sangrado activo.
El papel del TIPS en este
contexto es debatido y su utilidad se compara con respecto a la cirugía.
Un estudio incluyó pacientes que estaban sangrando activamente y con alto
riesgo de morir con cirugía urgente (sepsis, coma profundo, neumonía,
fracaso multiorgánico, fracaso renal, comorbilidad grave) a pesar del
tratamiento endoscópico urgente dentro de las 72 horas anteriores (42).
Los pacientes se estabilizaron tras tratamiento con balón y se implantó
un TIPS en las siguientes 12 horas. La hemostasia se logró en un 90 por
ciento y la supervivencia a los 30 días era del 63 por ciento; en aquéllos
sin compromiso pulmonar, la supervivencia fue del 90 por ciento. Estos
datos son muy superiores a aquéllos obtenidos con cirugía para pacientes
con una supervivencia estimada entre el 10 y el 20%.
Otro estudio comparó el
TIPS con el shunt portocava en H en 70 pacientes con hemorragia activa, a
los que se siguió durante cuatro años. Se encontró una proporción más
alta de resangrado y fracaso de tratamiento en pacientes con TIPS (57
contra 26 por ciento inicialmente; 64% contra 35% en el seguimiento) (43,
44).
Mientras estos datos subrayan el hecho que la cirugía todavía es una
opción del tratamiento razonable en algunos pacientes, no son fácilmente
generalizables debido al excepcionalmente alto porcentaje de resangrado en
este estudio. En otro ensayo no aleatorizado el TIPS era superior a la
transección esofágica (45).
El estudio más reciente
(46),
aunque retrospectivo y no aleatorizado, incluyó 40 pacientes con grados A
y B de Child seguidos seguidos durante dos años tras recibir TIPS o cirugía.
Los episodios de sangrado, las rehospitalizaciones y los costes eran
menores en el grupo de cirugía. La mortalidad a 30 días también fue
mejor en los pacientes operados, aunque a largo plazo fue similar.
Se necesitan ensayos de gran
potencia y aleatorizados para establecer el papel de la cirugía y el TIPS
en pacientes con fallo médico y endoscópico. Actualmente, el TIPS es de
elección en pacientes con alto riesgo quirúrgico. En pacientes con
riesgo aceptable es difícil precisar qué terapia es superior, dependiendo
en cada centro de la experiencia con una u otra técnica. La obstrucción
del TIPS (cercana al 90% a los tres años (47) puede no ser un
problema, puesto que estos dispositivos pueden revisarse y
repermeabilizarse de manera reglada (90% de los casos) (48),
comparándose favorablemente con la escleroterapia desde la perspectiva
coste/efectividad (49). Tampoco
la cirugía de derivación portocava constituye un obstáculo insalvable
para un futuro transplante, siendo únicamente contraindicación relativa
para el mismo, ya que técnicamente es perfectamente factible realizar la
técnica en un enfermo previamente intervenido.
Con respecto a la profilaxis del resangrado, el TIPS
parece ser eficaz con respecto a los fármacos. En un estudio aleatorizado
con 91 pacientes con estadios B/C de Child el dispositivo disminuyó la
incidencia de resangrado y la probabilidad del mismo (13% vs. 39% y 13%
vs. 49%) (48). Sin embargo la encefalopatía empeoró, el grado de
Child y la supervivencia no mejoraron y el coste fue superior. Parece
dudoso con estos datos que el TIPS sea superior a los fármacos en la
profilaxis del resangrado. Conclusiones parecidas pueden extraerse con
respecto a la terapia endoscópica aislada (50) o combinada con fármacos
(47),
salvo en un estudio con pacientes cirróticos avanzados, donde se redujo
la incidencia de sangrado sin incrementar la encefalopatía (51).
Así, el TIPS no puede considerarse una medida de primera elección en la
profilaxis del resangrado, cuando la hemorragia se ha contenido.
Recomendaciones
Podrían seguirse las
establecidas por las guías británicas modificadas (6):
La terapia inicial del sangrado por varices va dirigida
a la resucitación hemodinámica, medidas de soporte y la prevención y el
tratamiento de las complicaciones. Debería ser realizada en una unidad
donde el personal esté familiarizado con esta patología y con las técnicas
dirigidas a su control.
La resucitación inicial comprendería:
-
Dos vías (16 G) o mejor vía central
-
Cruzar 6 concentrados de hematíes
-
Corregir alteraciones en la coagulación o trombopenia
-
Proteger la vía si existe:
La somatostatina u octreotido (50 µg en bolo seguido
por 50 µg/h por la infusión intravenosa) puede administrarse rápidamente
en aquellos enfermos con un alto índice de sospecha de sangrado por
varices, mientras se realiza la endoscopia. La terapia continuada durante
cinco días con estos fármacos, una vez controlado el sangrado, se ha
mostrado eficaz en la prevención de nueva hemorragia respecto a la
escleroterapia (52).
La terapia endoscópica, bien por ligadura o bien por
escleroterapia, está considerada como la intervención de primera elección
en el tratamiento de la hemorragia por varices (27). Se debe
realizar de manera urgente, una vez logrado un cierto nivel de estabilidad
hemodinámica. Las varices esofágicas sangrantes se tratan mediante
escleroterapia o ligadura, según criterio del endoscopista. Si no se
pudiera realizar tratamiento endoscópico, se seguiría tratamiento con
somatostatina, insertándose un balón de Sengstaken en espera de nueva
endoscopia, TIPS o cirugía. No se ha establecido el papel del transplante
hepático en este escenario.
Si el sangrando activo
persiste o se repite dentro
de 48 horas (fallo terapéutico), debe intentarse un segundo abordaje
endoscópico. Si éste fallase debería pensarse en un procedimiento
definitivo, bien cirugía o TIPS en un centro especializado. La elección
depende de la condición clínica del paciente y el manejo de cada técnica
por parte del centro de referencia.
El paciente ideal para la
terapia quirúrgica debería reunir los siguientes criterios:
-
Función hepática relativamente preservada.
-
Fallo de la terapéutica endoscópica urgente.
-
Ausencia de complicaciones derivadas del sangrado o la endoscopia
(insuficiencia renal, isquemia hepática, perforación, etc.).
La opción quirúrgica
depende del entrenamiento y especialización del cirujano. Aunque una
derivación selectiva tiene algunas ventajas fisiológicas, puede
exacerbar la ascitis de manera marcada. Así, una desviación portocava
sería la opción preferible.
Varices gástricas
Existen dos tipos de varices
gástricas
-
Gastroesofágicas:
Tipo I: en fundus.
Tipo II: en cualquier otro sitio del estómago
-
Gástricas aisladas. Con peor pronóstico (Figura 2)
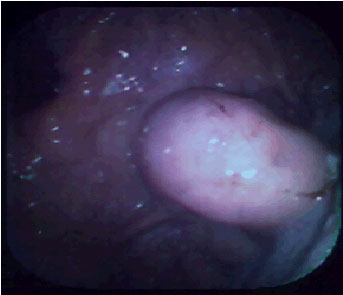
Figura
2. Variz gástrica aislada.
El manejo de las varices
gastroesofágicas es similar al ya descrito. El sangrado por varices gástricas
aisladas puede ser técnicamente difícil de tratar. Este tipo de varices
sangran con frecuencia a pesar de tratamiento endoscópico eficaz (del 60
al 90%). La endoscopia sólo sirve para confirmar el sitio de sangrado.
Se ha conseguido la
hemostasia y la eliminación de las varices con inyecciones de sustancias
esclerosantes, alcohol puro, y cianoacrilato (53, 54).
También la ligadura parece
un método eficaz en 16 de 18 pacientes con sangrado por variz gástrica
(88%) (55). Seis pacientes (22 por ciento) fallecieron; el
sangrado recurrió en el 19 por ciento. Muchos de estos pacientes tenían
hipertensión portal por esquistosomiasis. Así es difícil saber si estos
resultados son generalizables a pacientes con otras causas de cirrosis.
La inyección de
cianoacrilato se mostró más eficaz y seguro que la inyección del alcohol
(54) o la ligadura (56) en
dos pequeños ensayos controlados. Otras terapias como las bandas
elásticas (57)
y Los métodos radiológicos invasivos (58) también parecen útiles
en el control del sangrado y eliminación de las varices.
Otro enfoque prometedor es
la inyección intravariz de trombina (59). Una de las series más
grandes incluyó a 52 pacientes con sangrado gástrico por
varices que fueron tratados por inyecciones de trombina bovina (una
media de 1.070 IU se administró durante dos sesiones del tratamiento). La
hemostasia inicial se logró en el 94 por ciento. La mortalidad por sangrando
dentro de 72 horas fue del 6 por ciento. Después de seis semanas de
seguimiento, 9 de 49 pacientes sangraron de nuevo (18 por ciento) y un
paciente falleció (60).
En la actualidad, las
varices gástricas deben tratarse con octreotido (o somatostatina) y balón,
seguidos de TIPS o cirugía. El TIPS urgente parece ser tan eficaz para el
control del sangrado como en el caso de las varices esofágicas (61).
Sin embargo, el TIPS es menos eficaz que la cirugía en los pacientes que
tienen circulación colateral espleno-renal espontánea.
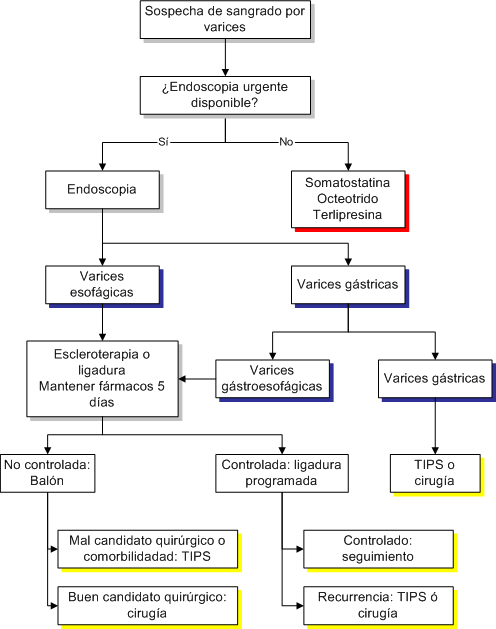
Un algoritmo general del
tratamiento de la hemorragia por varices puede verse en el esquema adjunto:
Bibliografía:
-
D'Amico
G, Pagliaro L, Bosch J. The treatment of portal hypertension: a meta-analytic
review. Hepatology 1995; 22(1):332-354.
-
Fort
E, Sautereau D, Silvain C, Ingrand P, Pillegand B, Beauchant M. A
randomized trial of terlipressin plus nitroglycerin vs. balloon
tamponade in the control of acute variceal hemorrhage. Hepatology
1990; 11(4):678-681.
-
Minocha
A, Richards RJ. Sengstaken-Blakemore tube for control of massive
bleeding from gastric varices in hiatal hernia. J Clin Gastroenterol
1992; 14(1):36-38.
-
Cello
JP, Grendell JH, Crass RA, Trunkey DD, Cobb EE, Heilbron DC.
Endoscopic sclerotherapy versus portacaval shunt in patients with
severe cirrhosis and variceal hemorrhage. N Engl J Med 1984;
311(25):1589-1594.
-
Burroughs
AK, Hamilton G, Phillips A, Mezzanotte G, McIntyre N, Hobbs KE. A
comparison of sclerotherapy with staple transection of the esophagus
for the emergency control of bleeding from esophageal varices. N Engl
J Med 1989; 321(13):857-862.
-
Selzner
M, Tuttle-Newhall JE, Dahm F, Suhocki P, Clavien PA. Current
indication of a modified Sugiura procedure in the management of
variceal bleeding. J Am Coll Surg 2001; 193(2):166-173.
-
LaBerge
JM, Ring EJ, Gordon RL, Lake JR, Doherty MM, Somberg KA et al.
Creation of transjugular intrahepatic portosystemic shunts with the
wallstent endoprosthesis: results in 100 patients. Radiology 1993;
187(2):413-420.
-
Rossle
M, Haag K, Ochs A, Sellinger M, Noldge G, Perarnau JM et al. The
transjugular intrahepatic portosystemic stent-shunt procedure for
variceal bleeding. N Engl J Med 1994; 330(3):165-171.
-
Sanyal
AJ, Freedman AM, Luketic VA, Purdum PP, Shiffman ML, Tisnado J et al.
Transjugular intrahepatic portosystemic shunts for patients with
active variceal hemorrhage unresponsive to sclerotherapy.
Gastroenterology 1996; 111(1):138-146.
-
Rosemurgy
AS, Goode SE, Zwiebel BR, Black TJ, Brady PG. A prospective trial of
transjugular intrahepatic portasystemic stent shunts versus small-diameter
prosthetic H-graft portacaval shunts in the treatment of bleeding
varices. Ann Surg 1996; 224(3):378-384.
-
Rosemurgy
AS, Serafini FM, Zweibel BR, Black TJ, Kudryk BT, Nord HJ et al.
Transjugular intrahepatic portosystemic shunt vs. small-diameter
prosthetic H-graft portacaval shunt: extended follow-up of an expanded
randomized prospective trial. J Gastrointest Surg 2000; 4(6):589-597.
-
Jalan
R, John TG, Redhead DN, Garden OJ, Simpson KJ, Finlayson ND et al. A
comparative study of emergency transjugular intrahepatic portosystemic
stent-shunt and esophageal transection in the management of
uncontrolled variceal hemorrhage. Am J Gastroenterol 1995;
90(11):1932-1937.
-
Helton
WS, Maves R, Wicks K, Johansen K. Transjugular intrahepatic
portasystemic shunt vs surgical shunt in good-risk cirrhotic patients:
a case-control comparison. Arch Surg 2001; 136(1):17-20.
-
Sauer
P, Hansmann J, Richter GM, Stremmel W, Stiehl A. Endoscopic variceal
ligation plus propranolol vs. transjugular intrahepatic portosystemic
stent shunt: a long-term randomized trial. Endoscopy 2002;
34(9):690-697.
-
Escorsell
A, Banares R, Garcia-Pagan JC, Gilabert R, Moitinho E, Piqueras B et
al. TIPS versus
drug therapy in preventing variceal rebleeding in advanced cirrhosis:
a randomized controlled trial. Hepatology 2002; 35(2):385-392.
-
Russo
MW, Zacks SL, Sandler RS, Brown RS. Cost-effectiveness analysis of
transjugular intrahepatic portosystemic shunt (TIPS) versus endoscopic
therapy for the prevention of recurrent esophageal variceal bleeding.
Hepatology 2000; 31(2):358-363.
-
Gulberg
V, Schepke M, Geigenberger G, Holl J, Brensing KA, Waggershauser T et
al. Transjugular intrahepatic portosystemic shunting is not superior
to endoscopic variceal band ligation for prevention of variceal
rebleeding in cirrhotic patients: a randomized, controlled trial.
Scand J Gastroenterol 2002; 37(3):338-343.
-
Pomier-Layrargues
G, Villeneuve JP, Deschenes M, Bui B, Perreault P, Fenyves D et al.
Transjugular intrahepatic portosystemic shunt (TIPS) versus endoscopic
variceal ligation in the prevention of variceal rebleeding in patients
with cirrhosis: a randomised trial. Gut 2001; 48(3):390-396.
-
Escorsell
A, Bordas JM, del Arbol LR, Jaramillo JL, Planas R, Banares R et al. Randomized
controlled trial of sclerotherapy versus somatostatin infusion in the
prevention of early rebleeding following acute variceal hemorrhage in
patients with cirrhosis. Variceal Bleeding Study Group. J Hepatol
1998; 29(5):779-788.
-
Sarin
SK. Long-term follow-up of gastric variceal sclerotherapy: an eleven-year
experience. Gastrointest Endosc 1997; 46(1):8-14.
-
Sarin
SK, Jain AK, Jain M, Gupta R. A randomized controlled trial of
cyanoacrylate versus alcohol injection in patients with isolated
fundic varices. Am J Gastroenterol 2002; 97(4):1010-1015.
-
Shiha
G, El Sayed SS. Gastric variceal ligation: a new technique.
Gastrointest Endosc 1999; 49(4 Pt 1):437-441.
-
Lo
GH, Lai KH, Cheng JS, Chen MH, Chiang HT. A prospective, randomized
trial of butyl cyanoacrylate injection versus band ligation in the
management of bleeding gastric varices. Hepatology 2001;
33(5):1060-1064.
-
Lee
MS, Cho JY, Cheon YK, Ryu CB, Moon JH, Cho YD et al. Use of detachable
snares and elastic bands for endoscopic control of bleeding from large
gastric varices. Gastrointest Endosc 2002; 56(1):83-88.
-
Kitamoto
M, Imamura M, Kamada K, Aikata H, Kawakami Y, Matsumoto A et al. Balloon-occluded
retrograde transvenous obliteration of gastric fundal varices with
hemorrhage. AJR Am J Roentgenol 2002; 178(5):1167-1174.
-
Heneghan
MA, Byrne A, Harrison PM. An open pilot study of the effects of a
human fibrin glue for endoscopic treatment of patients with acute
bleeding from gastric varices. Gastrointest Endosc 2002;
56(3):422-426.
-
Yang
WL, Tripathi D, Therapondos G, Todd A, Hayes PC. Endoscopic use of
human thrombin in bleeding gastric varices. Am J Gastroenterol 2002;
97(6):1381-1385.
-
Chau
TN, Patch D, Chan YW, Nagral A, Dick R, Burroughs AK. "Salvage"
transjugular intrahepatic portosystemic shunts: gastric fundal
compared with esophageal variceal bleeding. Gastroenterology
1998; 114(5):981-987.
Vicente Gómez Tello
Servicio de Medicina Intensiva
Clínica Moncloa, Madrid
©REMI, http://remi.uninet.edu.
Enero 2003.
Ir
a la cabecera de la página
Envía tu comentario
para su publicación |