|
La neumonía asociada a la
ventilación mecánica (NAV) representa el 80% de los episodios de neumonía
nosocomial y el término NAV debe aplicarse a los episodios de neumonía
que se desarrollan en pacientes intubados o traqueostomizados bajo
ventilación mecánica (VM). Sin embargo, es conveniente recordar que
habitualmente debemos referirnos a esta entidad como “neumonía probable”,
ya que el diagnóstico de certeza de la misma requiere evidencia
histológica o bien de imágenes (TAC) donde se demuestre absceso pulmonar
con obtención de cultivo positivo. Las definiciones y sus alcances se
aprecian en la Tabla I.
|
Tabla I: Criterios diagnósticos y
definiciones de NAV
|
| |
|
Neumonía definitiva:
Paciente con infiltrados nuevos o
persistentes y secreciones traqueobronquiales purulentas y que además
presenta uno de los siguientes:
-
Evidencia radiológica (TAC)
de absceso pulmonar y cultivo positivo por punción
-
Evidencia histológica de
neumonía de muestra de pulmón obtenida por biopsia o examen postmortem
inmediato con cultivo positivo (>104 microorg/gr tejido).
|
|
|
|
Neumonía probable:
Paciente con infiltrados nuevos o
persistentes y secreciones traqueobronquiales purulentas y que además
presenta uno de los siguientes:
-
Cultivo cuantitativo de
muestra profunda
-
Hemocultivo positivo sin
relación con otro foco y obtenido 48 horas antes o después de la muestra
respiratoria, con gérmenes idénticos
-
Cultivo positivo de
líquido pleural sin instrumentación previa
-
Evidencia histológica
con cultivo negativo (<104 microorganismos / g. de tejido)
|
|
|
|
Ausencia definitiva:
Sin los criterios anteriores y:
-
Evidencia histológica
negativa dentro de los 3 días de sospecha de NAV
-
Etiología alternativa
segura y no crecimiento bacteriano en las muestras
-
Identificación citológica
de un proceso distinto a NAV ( p.ej: neoplasia)
|
|
|
|
Ausencia probable: Falta de
crecimiento en muestra confiable y además 1 de:
-
Resolución sin ATB
-
Fiebre e infiltrados
persistentes con diagnósticos alternativos seguros
|
|
|
La NAV es la infección más frecuente
en las unidades de cuidados intensivos (UCI) [1]
y es la responsable de más de la mitad de los antibióticos prescritos en el sector. Es habitual diferenciar la NAV según la
temporalidad del evento en:
Precoz: cuando se inicia en los
primeros días de VM o del ingreso. No existe consenso en cuanto al
número de días y los distintos autores suelen considerar tiempos menores a
una semana (entre 4 y 7 días) [2,
3]. Es causada frecuentemente
por bacterias que colonizan de forma habitual la orofaringe, como
Streptococcus pneumoniae, Haemophilus influenzae, Staphylococcus aureus
sensible a meticilina (SASM), etc.
Tardía: cuando se desarrolla después
de los 7 días. Es causada por patógenos hospitalarios que colonizan
progresivamente la orofaringe durante el ingreso, como
Staphylococcus
aureus resistente a meticilina (SARM),
Pseudomonas aeruginosa, Klebsiella
spp.,
Acinetobacter spp., etc.
Si bien esta diferenciación puede
ser práctica desde un punto de vista didáctico/docente, hay que tener
presente, sobre todo de cara al tratamiento antibiótico inicial adecuado, que
existen múltiples factores (del paciente o del medio) que pueden influir
en la etiología de la NAV.
La importancia de esta entidad está
determinada por su elevada frecuencia de aparición y por su alta
mortalidad, aunque cuántos pacientes podrían sobrevivir si se evitara la aparición de NAV es una cuestión muy controvertida [4,
5].
Este manuscrito revisa los nuevos
aspectos de la NAV en adultos, haciendo especial énfasis en el manejo
terapéutico.
La incidencia de NAV varía en un
amplio rango según la población que se considere, desde 5 casos por
1.000
días de ventilación mecánica en pacientes críticos pediátricos hasta 16 casos/1.000
días de ventilación en pacientes quemados o traumáticos [6].
Kollef [7], por su
parte, informa una incidencia variable de NAV, que oscila entre un
21,6% para pacientes en cirugía cardiaca, hasta un 14% para pacientes de
cirugía general y 9,3% para pacientes con etiologías médicas.
La intubación de la vía aérea es el
principal factor de riesgo para el desarrollo de NAV [8].
Un clásico estudio multicéntrico llevado a cabo por la Sociedad Española
de Intensivos (SEMICYUC) en más de 16.000 pacientes, evidenció un riesgo de
neumonía nosocomial 23,6 veces superior en
pacientes intubados (8,7%)
respecto de aquellos pacientes que no requirieron invasión de la vía aérea
(0,3%). El riesgo acumulativo de desarrollar NAV
es del 1% por día de ventilación mecánica, pero este riesgo se concentra
fundamentalmente en los primeros días post-intubación [9]
y disminuye progresivamente hasta ser mínimo luego de 2 semanas de
ventilación mecánica [10].
Las variables significativamente asociadas con el desarrollo de NAV
también varían según la población en estudio y la técnica empleada para el
diagnóstico. En la Tabla II se muestran los principales estudios que
evidencian factores asociados con el desarrollo de NAV luego de realizar
análisis multivariado [11].
|
Tabla II:
Factores asociados con el desarrollo de NAV [§]
|
| |
|
Autor/diagnóstico |
Factores |
Asociación |
Días VM |
Microorganismos |
|
|
|
|
|
|
|
Craven (1986), diagnóstico clínico |
1. Monitor PIC
2. Cimetidina
3. Cambio circuito/ 24 horas |
OR 4,2
OR 2,4
OR 2,3 |
10
± 10 |
P. aeruginosa
K. pneumoniae
S. marcescens |
|
Torres (1990), broncoscopia |
1. Aspiración gástrica
2. Reintubación
3. EPOC
4. VM > 3 días
5. PEEP |
OR 5,5
OR 5,1
OR 1,9
OR 1,1
OR 1,8 |
— |
Flora polimicrobiana
A. calcoaceticus
P. aeruginosa |
|
Kollef (1994), diagnóstico clínico |
1. Índice de DMO > 3
2. Edad > 60 años
3. Antibióticos previos
4. Posición supina |
OR 10,2
OR 5,1
OR 3,1
OR 2,9 |
20,1
±
15,2 |
Enterobadcter
K. pneumoniae
S. aureus
P. aeruginosa |
|
Rello (1994), broncoscopia |
1. EPOC
2. VM > 8 días |
RR 18,3
RR 7,5 |
— |
P. aeruginosa |
|
Rello (1996), broncoscopia |
1. Aspiración subglótica
2. Neumotaponamiento > 20 cmH2O
3. Antibióticos |
RR 5,3
RR 4,2
RR 0,1 |
3 a 7 |
P. aeruginosa
H. influenzae
S. pneumoniae |
|
Cook (1999), broncoscopia |
1. Quemados
2. Trauma
3. Daño neurológico
4. Enfermedades respiratorias
5. VM 24 horas previas
6. Aspiración comprobada
7. Uso de bloqueantes
neuromusculares |
RR 5,0
RR 5,0
RR 3,4
RR 2,79
RR 2,28
RR 3,25
RR 1,57 |
19,3
±
16 |
— |
|
Rello (1999), broncoscopia |
1. Paro cardiaco
2. Sedación continua
3. Ausencia de antibióticos |
OR 5,1
OR 4,4
OR 0,2 |
1 a 2 |
S. aureus
H. influenzae
S. penumoniae |
|
Rello (2002), clínica y/o broncoscopia |
1. Sexo masculino
2. Trauma
3. Nivel de gravedad medio |
OR 1,5
OR 1,7
OR 1,4-1,7 |
— |
P. aeruginosa
S. aureus |
|
|
|
§
Rodríguez
A, Rello J. Neumonía asociada a la ventilación mecánica. En PROATI (ciclo
3), capítulo 9, 1999. Editorial Médica Panamericana. [11] |
|
|
Un estudio caso-control reciente
sobre una gran base de datos de USA [12] evidenció que factores como el
sexo masculino (OR 1,5)
o el trauma (OR 1,7)
estaban asociados de manera independiente al
desarrollo de NAV. Como dato interesante, este mismo estudio halló que
niveles intermedios de gravedad (OR 1,4-1,7)
se asociaron a mayor incidencia de NAV. Esto implicaría que a menores
niveles de gravedad, la exposición al riesgo (intubación) podría no ser
suficiente para desarrollar NAV. Por el contrario, en niveles elevados de
gravedad, los pacientes podrían morir antes de desarrollar la neumonía.
Por ello es que el grupo de mayor riesgo es aquel de gravedad intermedia,
y éste podría ser el que más se beneficie del tratamiento
antibiótico (ATB) adecuado en
la NAV.
Por otra parte, los factores de
riesgo parecen variar con el tiempo de intubación [13]. La administración
de ATB dentro de las primeras 48 horas de
la intubación parece tener un efecto protector
para el desarrollo de NAV (OR 0,29)
[9], pero la exposición previa
a los mismos incrementa el riesgo (OR 1,4) de
NAV tardía [10].
Aunque la neumonía nosocomial
representa un porcentaje relativamente bajo de las infecciones
intrahospitalarias (15%), es la patología con mayor mortalidad. La
mortalidad bruta de la neumonía nosocomial oscila entre el 20 y 70%,
y en la UCI se encuentra entre el 20 y el 40% [14].
La mortalidad atribuible (muertes que podrían haberse evitado
si no se hubiera desarrollado la NAV) es un tema controvertido [15].
En varios estudios [16-18]
la mortalidad atribuible osciló entre un 27-33%, demostrando que aquellos
que requieren VM y desarrollan NAV tienen un riesgo de morir de 2 a 2,5
veces mayor que los controles. Sin embargo, un estudio caso-control
reciente [12] no
evidenció una mayor mortalidad en pacientes con NAV respecto de aquellos
libres de esta complicación (30,5% frente
a 30,4%).
Tal como sugieren Rello y Vallés [19],
la evolución final de un paciente con NAV es altamente dependiente de 3
factores [20]:
1) la virulencia del germen
en cuestión; 2) las defensas del huésped y 3) la institución de una
apropiada terapia antimicrobiana inicial. A diferencia de lo que acontece
con la neumonía comunitaria grave, donde la mortalidad puede ser atribuida
enteramente a esta entidad, en la NAV el evento desencadenante inicial (
injuria de cualquier etiología) que lleva al paciente a ingresar en la UCI,
es parcialmente responsable de la mortalidad cruda registrada. Como
sugieren Girou y col. [21],
para establecer la verdadera relación entre la gravedad de la enfermedad,
la actividad terapéutica, la ocurrencia de infección nosocomial y la
evolución final , se requiere por una parte el análisis aislado de la
gravedad y la actividad terapéutica asociada como causa de infección
nosocomial. Pero, por otra parte, es necesario el análisis de la infección
nosocomial como causa de exceso de gravedad y de actividad terapéutica
extra. Este tipo de análisis es muy complejo y difícil de realizar en la
práctica, permaneciendo en el plano de la teoría. Por último, y
complicando más la cuestión, el verdadero exceso de mortalidad atribuible
a la NAV se podría obtener mediante estudios caso/control, pero debería
calcularse únicamente sobre pacientes con tratamiento ATB adecuado
[19].
Más allá de todas estas limitaciones,
es conveniente recordar que la mortalidad en la NAV parece estar
directamente relacionada con el nivel de gravedad al ingreso en la UCI (especialmente
en los niveles intermedios) [12],
la edad avanzada, la presencia de gérmenes considerados de alto riesgo,
como Pseudomonas spp. y
Staphylococcus aureus [22,
23], y sobre todo con la
administración tardía o inadecuada del tratamiento antibiótico inicial [24-28].
Finalmente, la morbilidad y los costes de los pacientes que desarrollan
NAV también son elevados, registrándose un incremento en el tiempo de VM
(10 días) y una mayor estancia en la UCI (6 días) [12].
Podemos clasificar las causas de
producción de neumonía nosocomial desde un punto de vista de la ruta de
acceso de los microorganismos :1) contigüidad ; 2) vía hematógena; 3) vía
inhalatoria y 4) aspiración. Las 2 primeras causas son excepcionales, con
un limitado papel en el desarrollo de NAV. La vía inhalatoria suele estar
representada por la contaminación de los circuitos del ventilador o bien
de las soluciones nebulizadas. La contaminación de los circuitos del
ventilador es una constante y parece no afectar la incidencia de NAV
[29]. Sin embargo, en nuestro
medio, y a diferencia de lo que sucede a nivel internacional [29-32],
la utilización de dispositivos como la nariz artificial, disminuye
significativamente la elevada incidencia de NAV. Es probable que ésto se
deba a un inadecuado manejo de la vía aérea, con inhalación del condensado
de las tubuladuras, el cual conlleva una elevada carga bacteriana. Sin
lugar a dudas, la principal ruta de origen de la NAV es la aspiración. La
colocación del tubo endotraqueal mantiene las cuerdas vocales abiertas y
permite el paso de secreciones acumuladas en el espacio subglótico hacia
la vía aérea inferior. La magnitud de esta “microaspiración” se puede
disminuir si se coloca al paciente en posición semisentada con la cabecera
a más de 45º [33]. Esta
sencilla actitud no se encuentra generalizada en las UCIs de nuestro medio.
La posibilidad de utilizar tubos endotraqueales con drenaje subglótico
[34], así como evitar que la
presión dentro del neumotaponamiento (manguito) decaiga a valores
inferiores a 25 cmH2O [35],
podría reducir el riesgo de NAV precoz, aunque su efecto sobre la neumonía
de desarrollo tardío es discutible. Cuando el tubo endotraqueal permanece
en posición por varios días, en su superficie interna se desarrolla una
capa de biofilm infectado. Estudios preclínicos [36]
sugieren que tubos endotraqueales impregnados con plata pueden retrasar la
colonización de estos dispositivos. Éstos, como otras medidas de
prevención de la NAV, son tratadas en el capítulo correspondiente.
Tanto la American Thoracic Society (ATS) [37]
como informes franceses [2]
distribuyen los microorganismos responsables de la NAV de acuerdo a
diferentes factores de riesgo. Si bien parece más acertada la orientación
francesa de clasificar a los pacientes según los días de VM y la
exposición previa a los ATB, Rello y col. [38]
al comparar los hallazgos etiológicos en cuatro centros, evidenciaron que
las causas de NAV varían ampliamente aún dentro de un mismo grupo de
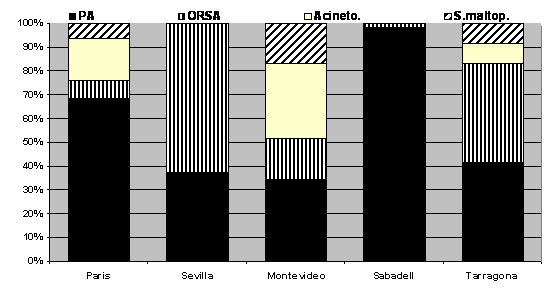
riesgo definido [2]. Esta variación existe no sólo dentro de diferentes comunidades (Figura 1)
sino que se puede presentar en diferentes UCIs de un mismo hospital. Esto
obliga a que la política antibiótica empírica inicial deba ser ajustada en cada
UCI según los patrones locales de sensibilidad. En la Tabla
III se enumeran
la distribución de los microorganismos aislados en diversos estudios
[2, 38, 41]. Por otra parte, factores
como la administración previa de antibióticos, el tiempo de hospitalización y la presencia de comorbilidades pueden influir en la probabilidad de aislar un
microorganismo en particular. En la tabla IV se enumeran las condiciones
que predisponen a la adquisición de uno u otro germen.
Figura 1: Patrones de distribución de patógenos
potencialmente multirresistentes en diferentes instituciones de España,
Uruguay y Francia, clasificados dentro del grupo IV definido por Trouillet
[2], que incluye pacientes con VM de más de 7 días y tratamiento
antibiótico previo. PA: Pseudomonas aeruginosa; ORSA:
Staphylococcus aureus resistente a meticilina; Acineto:
Acinetobacter baumannii; S. Maltop: Stenotrophomonas maltophilia.
(adaptado de [40])
|
Tabla III:
Etiología de la NAV
|
| |
|
|
Ibrahim [39]
n = 420 |
Trouillet [2]
n = 245 |
Rello [37]
n = 301 |
|
Gram + |
|
|
|
|
SARM |
81 (19,3%) |
20 (8,2%) |
10 (3. 3%) |
|
SASM |
62 (14,7%) |
32 (13,1%) |
38 (12,6%) |
|
S. pneumoniae |
6 (1,4%) |
3 (1,2%) |
25 (8,3%) |
|
Otros Streptococci |
NC |
33 (13,5%) |
10 (3,3%) |
|
Otros gram + |
NC |
23 (19,4%) |
24 (7,8%) |
|
Gram – |
|
|
|
|
P. aeruginosa |
130 (30,9%) |
39 (15,9%) |
102 (33,9%) |
|
H. influenzae |
19 (4,5%) |
15 (6,1%) |
26 (8,6%) |
|
Enterobacter spp. |
43 (10,2%) |
5 (2,0%) |
44 (14,6%) |
|
S. maltophilia |
38 (9,0%) |
6 (2,4%) |
8 (2,6%) |
|
K. pneumoniae |
25 (5,6%) |
9 (3,7) |
0 (0%) |
|
A. baumannii |
16 (3,8%) |
22 (9,0%) |
38 (12,6%) |
|
Serratia spp. |
13 (3,1%) |
4 (1,6%) |
0 (0%) |
|
E. coli |
9 (2,2%) |
8 (3,3%) |
NC |
|
Proteus spp. |
9 (2,1%) |
7 (2,4%) |
0 (0%) |
|
Otros: |
19 (4,5%) |
13 (5,3%) |
23 (7,6%) |
|
|
|
|
|
|
Flora anaeróbica |
NC |
6
(2,4%) |
NC |
|
Hongos |
28 (6,6%) |
NC |
NC |
|
Virus |
5 (3,1%) |
NC |
NC |
|
|
|
|
|
|
NC: No comunicado; SARM: Staphylococcus aureus
resistente a meticilina; SASM: Staphylococcus aureus sensible a
meticilina. (adaptado de [42]) |
|
|
|
Tabla IV: Condiciones
predisponentes a NAV de los 10 patógenos más frecuentes
|
| |
|
Microorganismo |
ATB previo |
Tiempo de hospitalización |
Comorbilidades |
Otras |
Autor/año |
|
SASM |
No |
< 7 días |
Coma, trauma cirugía |
|
Espersen 1981; Rello 1991 |
|
SARM |
Sí |
> 7 días |
EPOC, corticoides |
Presión de colonización, edad, descontaminación |
Sandiumenge 2003; Pickworth 1993; González 1999; Pujol 1998 |
|
S. pneumoniae |
No |
< 7 días |
|
|
Berk 1989 |
|
H. influenzae |
No |
< 5 días |
Alcoholismo, EPOC, inmunodepresión primaria |
|
Jallat 1991; Rello 1992 |
|
P. aeruginosa |
Sí |
> 7 días |
EPOC, SDRA, neutropenia |
Neumonía previa, desnutrición |
Trouillet 1998; Rello 1996; Silver 1992; Rello 1994 |
|
A. baumannii |
|
Variable |
SDRA, aspiración, trauma, neurocirugía |
Presión de colonización, contaminación de dispositivos |
Fagon 1993; Garnacho 2003, Rello 2003; Villegas 2003 |
|
S. maltophilia |
Imipenem |
> 7 días |
ISS elevado, contusión pulmonar |
Contaminación de dispositivos |
Hanes 2002; |
|
Enterobacteriaceae |
|
< 7 días |
|
Contaminación de dispositivos, manos del personal |
Berk 2002; Rello 2003 |
|
Anaerobios |
|
< 5 días |
Coma |
Aspiración |
Bonten 1994 |
|
Patógenos oportunistas |
Sí |
|
Neutropenia, corticoides, quimioterapia, neoplasias, trasplantes |
|
Craven 1994; Wunderink 1992; Fagon 1994; Rello 1998; Papazian 1996;
Rodríguez 2001 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SARM: Staphylococcus aureus resistente a
meticilina; SASM: Staphylococcus aureus
sensible a meticilina (modificado de [42]) |
|
|
Describiremos ahora brevemente las
principales características de los microorganismos más frecuentes, y sobre todo
las condiciones particulares de los “potencialmente” resistentes.
H.
influenzae, S. pneumoniae y
SASM
se aislan frecuentemente en la NAV precoz y deben ser considerados en
pacientes que no han recibido antibióticos. Los politraumatizados son típicamente
los pacientes en quienes esperamos hallarlos. Su mortalidad atribuible es
escasa con tratamiento adecuado, ya que el pronóstico depende más de la
gravedad de la patología subyacente que de la complicación infecciosa añadida. En cambio,
el SARM debe sospecharse en pacientes con enfermedad pulmonar
previa, corticoides, VM prolongada y sobre todo, en aquéllos que han tenido
exposición previa a ATB [43].
Si el paciente se encuentra en VM pero no ha recibido antibióticos
previos (salvo en unidades
donde existe endemia) la cobertura de SARM no
estaría indicada de forma empírica [44].
La importancia de su reconocimiento y tratamiento radica en que el
SARM es la
segunda causa de muerte por NAV. La bacteriemia y el shock séptico son
tres veces más frecuentes en la neumonía, mientras que la mortalidad es 20
veces mayor que la registrada en los episodios de NAV causados por
SASM
[23].
P.
aeruginosa es otro microorganismo
de gran importancia en la NAV. Está estrechamente asociada a lesiones
necróticas pulmonares y a recidivas (reactivaciones) [45].
Se reconoce una mortalidad atribuible superior al 10% [46],
incluso con tratamiento adecuado y prolongado. Los factores asociados con
mayor posibilidad de aislamiento son: enfermedad pulmonar crónica (bronquiectasias, EPOC); exposición previa a
antibióticos, ventilación mecánica por más de 7 días y
el aislamiento previo del microorganismo como infección y/o colonización
[2, 45,
46]. El agua del grifo es un
reservorio común a tener presente en epidemias [47],
mientras que la contribución del tubo digestivo en la génesis de la NAV es
marginal. La virulencia y citotoxicidad de este microorganismo está
relacionada con la producción de proteínas (Exo-U) por parte del sistema
de secreción tipo III y la expresión del sistema Quorum-sensing. Sobre
estos aspectos se ensayan actualmente nuevas modalidades de tratamiento y
prevención de la infección.
A. baumannii es un patógeno aislado
con elevada frecuencia en las UCIs. Su adquisición es exógena, y cuando se
presenta como causante de NAV precoz se asocia con mal manejo de la vía
aérea y alta presión de colonización. A pesar de la elevada resistencia a
múltiples ATB, su impacto sobre la mortalidad es marginal [48,
49] si es tratado
adecuadamente.
Dentro de las enterobacterias,
Klebsiella pneumoniae es la de mayor importancia, siendo el segundo
microorganismo aislado con más frecuencia en USA [50],
aunque al emplearse métodos diagnósticos con alta especificidad, la
incidencia parece ser menor (Tabla III). El desarrollo de betalactamasas de
espectro ampliado (BLEA) es responsable de la resistencia de muchas de
estas cepas a diferentes cefalosporinas de tercera y cuarta generación.
Como regla general no se recomienda utilizar cefalosporinas para el
tratamiento de este microorganismo, salvo que se haya descartado que la
cepa es productora de BLEA.
Por último, Candida spp. se aisla
con elevada frecuencia en muestras respiratorias, sin embargo su papel en
pacientes no inmunosuprimidos es muy pobre y su presencia no tiene
relevancia clínica, debiendo ser considerada como “colonización” más que
una verdadera infección.
Los pacientes de UCI frecuentemente
desarrollan fiebre en su evolución; cuando esto
ocurre es obligado
descartar focos de sepsis. Uno de los más frecuentes es el pulmón, sobre
todo en los pacientes que se encuentran con invasión de la vía aérea.
El diagnóstico de la NAV es un tema
controvertido. Nosotros intentaremos resumir las corrientes actuales de
opinión, considerando los puntos básicos para el diagnóstico de esta
entidad.
El primer paso en el camino hacia el
diagnóstico de NAV es la “sospecha clínica”. Los criterios ampliados de
Johanson (1972) continúan teniendo vigencia. Éstos incluyen:
-
Infiltrados nuevos o progresivos en la radiografía de tórax (RXT)
-
Fiebre
-
Leucocitosis
-
Secreciones traqueobronquiales purulentas
De los 4 criterios citados, dos
tienen una importancia extrema. Considerando que la neumonía surge de la
invasión de un microorganismo en el parénquima pulmonar, la respuesta
inflamatoria que se desencadena (excepto en inmunosuprimidos) conlleva a
la aparición de secreciones purulentas. Por ello, la ausencia de
secreciones purulentas pone en duda el diagnóstico de NAV [51].
Por otra parte, en los pacientes intubados es frecuente que las
secreciones sean abundantes y purulentas. El único
modo para diferenciar
la “traqueobronquitis” purulenta de la NAV es la presencia de infiltrados
pulmonares. Por ello, la ausencia de infiltrados en la RXT pone en duda
el diagnóstico de NAV. La decisión de tratar o no una traqueobronquitis
purulenta es un tema muy debatido,
que escapa al objetivo de este
capítulo. Sólo mencionaremos que en pacientes con inestabilidad
hemodinámica, fiebre y secreciones purulentas (sin otros focos evidentes
de infección), algunos autores deciden efectuar tratamiento
antibiótico [52,
53], con resultados poco
claros. Sin embargo existen muchas limitaciones al momento de realizar
una adecuada radiografía de tórax en la UCI [54].
El tiempo de exposición al rayo, el desplazamiento posterior y compresión
del mediastino, todo ello sumado a la visión anteroposterior que nos
ofrece la radiografía, puede magnificar o bien ocultar imágenes patológicas de
infiltrados. Varios autores [54-56]
evidenciaron una mala correlación de los hallazgos radiológicos con el
lavado broncoalveolar (LBA) y las autopsias. Sólo la presencia de
infiltrados alveolares o bien de broncograma aéreo distal (bronquios
medios) ha demostrado un valor predictivo positivo del 68% [54,
55]. Aproximadamente un 20%
de los infiltrados pueden no ser observados en la RXT y la TAC puede
resolver este interrogante, dada su elevada especificidad. Sin embargo, la
TAC no está indicada de forma rutinaria en la sistemática de diagnóstico
de la neumonía [57].
El diagnóstico diferencial debe incluir: aletelectasia, edema agudo
de pulmón, tromboembolismo y hemorragia pulmonar, entre los más frecuentes.
La puntuación de Pugin y col. [58]
(CPIS:
Clinical Pulmonary Infection Score) fue
desarrollada para realizar una predicción de probabilidad de neumonía. Los
parámetros considerados se presentan en la Tabla V. Utilizando un punto de
corte de 6 puntos (la puntuación varía desde 0 a 12 puntos) para definir alta
probabilidad de NAV, se observó una sensibilidad del 72-85% y una
especificidad del 85-91% [59,
60]. Sin embargo, cuando se
comparó con los hallazgos en autopsias la sensibilidad cayó al 77% y la
especificidad fue muy pobre del 42% [61].
Por otra parte, el CPIS es utilizado para monitorizar la resolución de la
NAV durante su asistencia [62]
o bien decidir la suspensión de los antibióticos si
la puntuación se mantiene por debajo
de 3 después del tercer día de tratamiento [63].
Por desgracia, el CPIS tiene elementos subjetivos mas allá de otros con
carácter retrospectivo (cultivos). Esto limita su utilidad de cara al
diagnóstico en el día a día.
|
Tabla V: CPIS (Clinical Pulmonary
Infection Score)
[58]
|
| |
|
|
Puntos |
|
Temperatura |
|
|
36,5-38,4º C |
0 |
|
38,5-38,9º C |
1 |
|
< 36,5º C ó > 38,9º C |
2 |
|
Leucocitos |
|
|
4.000-11.000/mm3 |
0 |
|
< 4.000 o > 11.000 |
1 |
|
> 50% cayados |
Añadir 1 punto |
|
Secreciones traqueales |
|
|
Ausentes |
0 |
|
Secreciones no purulentas |
1 |
|
Secreciones purulentas |
2 |
|
Oxigenación: |
|
|
pO2/FiO2
> 240 o SDRA |
0 |
|
pO2/FiO2
< 240 y no SDRA |
2 |
|
Radiografía de tórax |
|
|
No infiltrados |
0 |
|
Infiltrado difuso |
1 |
|
Infiltrado localizado |
2 |
|
Progresión del infiltrado |
|
|
Sin progresión |
0 |
|
Con progresión |
2 |
|
Cultivo del aspirado |
|
|
Poco o nulo crecimiento |
0 |
|
Crecimiento moderado o intenso |
1 |
|
Visualización en el Gram |
Añadir 1 punto |
|
|
En síntesis, se debe sospecharse NAV
en pacientes con secreciones purulentas e infiltrados en la
radiografía de tórax, que se
encuentran en VM y que presentan fiebre con o sin leucocitosis. En estos
pacientes la administración precoz de ATB empíricos debe ser considerada
una prioridad. Sin embargo, antes de administrar ATB, es
obligatoria la obtención de una
muestra de secreciones respiratorias, y pocas excusas pueden
salvar esta obligación.
En la práctica, la
tinción de
Gram de la muestra obtenida, se presenta como una técnica rápida y de
fácil realización, que nos puede ayudar a orientarnos en el tratamiento
antibiótico inicial. Existe un intenso debate sobre
qué técnica de obtención de
muestras presenta mayor rentabilidad en el diagnóstico de la NAV. El
aspirado traqueal cuantitativo (ATC),
LBA y cepillo telescopado
protegido (CTP) son
los más utilizados. La rentabilidad de estos procedimientos es similar (Tabla
VI) [64], siendo tal vez
más importante centrar el debate sobre la necesidad de obtener una
muestra de “calidad” en lugar de qué tipo de procedimiento en particular
se deba utilizar para obtenerla, ya que no hay una clara evidencia (sólo
nivel B) que demuestre la superioridad de alguno de estos procedimientos
para el diagnóstico de NAV [65] ni cuál es el impacto que ellos provocan
sobre la mortalidad [66,
67]. En nuestra experiencia
[3], la utilización de
técnicas broncoscópicas y ATC logró la identificación del patógeno en un
93% y 90% respectivamente. Mertens y col. [68]
comunicaron que el hallazgo de menos de un 10% de neutrófilos en una muestra de
“calidad” obtenida por broncoscopia se asocia invariablemente con
cultivos negativos, por lo cual, ante esta situación, se deben valorar
otros diagnósticos diferentes a la NAV. La calidad de la muestra puede y
debe evaluarse mediante la presencia de células epiteliales. Un recuento
mayor al 1% de células epiteliales en muestras invasivas sugiere una
elevada contaminación orofaríngea y la muestra no debería remitirse a
cultivo, ya que su interpretación resulta muy difícil [51].
Este nivel de células escamosas puede elevarse a 10 por campo (X100) para
ATC [69]. Es muy
importante que el informe del laboratorio de microbiología sea
interpretado tomando en consideración la “calidad” de la muestra, el
cuadro clínico del paciente (factores de riesgo) y la potencial
interferencia que pueda resultar de los antibióticos sobre los cultivos [51,
70]. De ser posible se debe
realizar una técnica broncoscópica, que presenta más especificidad, aunque
muchas veces no estará disponible. En estas condiciones el ATC es
una opción práctica que no se debe pasar por alto. La modificación
“tardía” de los ATB en base a procedimientos invasivos en
los
pacientes con mala evolución clínico-radiológica, tiene poco impacto
sobre la mortalidad [70];
en contraste, la modificación precoz de un antibiótico inapropiado sobre la base de
los resultados de muestras obtenidas de forma temprana (dentro de las 12
horas de sospecha de NAV) se asoció con una
buena evolución en el 63% de los episodios [25].
|
Tabla VI:
Rentabilidad de los procedimientos para obtener muestras
respiratorias [64]
|
| |
|
|
Sensibilidad |
Especificidad |
|
Mínimamente invasivos |
|
|
|
Aspirado traqueal cuantitativo (106) |
70-100% |
14-47% |
|
|
|
|
|
Invasivos |
|
|
|
Lavado broncoalveolar
(104) |
73-93% |
70-100% |
|
Cepillo telescopado protegido
(103) |
66-100% |
72-100% |
|
Técnicas no broncoscópicas |
60-100% |
70-100% |
|
|
Como consideración práctica: ¡evitar
el retraso de la obtención de la muestra y el inicio del
antibiótico es mucho más
importante en la evolución que el tipo de técnica utilizada! [5].
El tratamiento de la NAV, como el de
cualquier otro proceso séptico, se basa principalmente en 3 puntos: 1)
Adecuado soporte cardiorrespiratorio, 2) Reducción del crecimiento
bacteriano mediante los antibióticos y 3)
Terapias coadyuvantes [40].
El soporte cardiopulmonar es fundamental en el tratamiento de la sepsis y
será desarrollado en un capítulo especial. El tratamiento coadyuvante
tiene un papel aún incierto en el tratamiento de la sepsis y sólo se
mencionará superficialmente dadas las limitaciones de espacio del texto.
Centraremos nuestro desarrollo en el
papel trascendental de los antibióticos en el tratamiento de la sepsis.
Comenzaremos por remarcar que el “retraso” o la “administración inadecuada”
del antibiótico en la NAV se asocia a un incremento significativo de la
mortalidad (Figura 2).
Figura 2. Tratamiento empírico inadecuado y mortalidad
hospitalaria
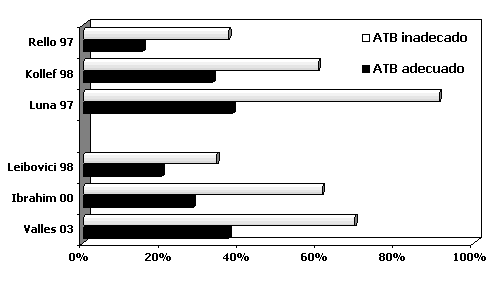
El incremento en la supervivencia en pacientes con
NAV depende de la rápida y adecuada terapia inicial [25,
71]. En los pacientes
críticos no hay posibilidad de una segunda oportunidad de tratamiento, por
lo que un antibiótico de amplio espectro será en general la decisión inicial
hasta obtener los resultados de microbiología. Las cuestiones claves a
responder en los pacientes con NAV son las siguientes:
-
¿Cuándo iniciar el tratamiento ATB?
-
¿En qué dosis?
-
¿Con qué agente empezamos?
-
¿Qué microorganismos deben ser cubiertos?
-
¿Qué duración debe tener el tratamiento?
-
¿Qué resultados de microbiología pueden
determinar cambios de antibiótico?
|
Tabla VII: Los 10 puntos clave de
la "estrategia de Tarragona" [44]
|
| |
|
1 |
El antibiótico debe ser administrado inmediatamente |
|
2 |
La elección del antibiótico puede ser elegida, en algunos casos, por la
tinción de Gram |
|
3 |
La prescripción del antibiótico debe ser modificada con los resultados
microbiológicos |
|
4 |
La prolongación del tiempo con tratamiento antibiótico no previene las
recurrencias |
|
5 |
Los pacientes con EPOC o con una semana de intubación deben recibir una
combinación de antibióticos, debido al riesgo de NAV por Pseudomonas
aeruginosa |
|
6 |
El SASM es muy frecuente en pacientes comatosos. No se debe sospechar la
presencia de SARM en ausencia de antibioterapia previa |
|
7 |
No se requieren antifúngicos aun en presencia de colonización por
Candida spp. |
|
8 |
La administración de vancomicina en la NAV por gram positivos se asocia a
mal pronóstico |
|
9 |
La elección específica de cada agente debe basarse en la exposición previa
a antibióticos |
|
10 |
Las guías de tratamiento deben ser actualizadas regularmente y ajustarse a
los parámetros locales de sensibilidad |
|
|
La Tabla VII describe los puntos clave
sobre los cuales se basa la estrategia de manejo de la NAV en nuestra
Institución [44]. Además, proponemos utilizar un concepto más amplio al
referirnos a antibiótico “apropiado” [40], no limitándonos simplemente al mero
hecho del resultado “in vitro” de la actividad del antibiótico sobre el germen,
sino a un concepto holístico que incluye: la administración precoz de un
antibiótico con
el espectro adecuado (para cubrir los posibles patógenos), a una
dosis adecuada (para el paciente crítico) que asegure una correcta
penetración en el órgano diana. En la Tabla
VIII se presentan las condiciones para considerar
a un
antibiótico como adecuado.
|
Tabla VIII: Requisitos para
considerar un antibiótico adecuado [40]
|
| |
|
a.- |
Inicio |
|
|
1.- Inmediato (en menos de una hora desde la sospecha clínica) |
|
|
2.- De amplio espectro |
|
b.- |
Administración |
|
|
1.- Dosis adecuada |
|
|
2.- Tiempo de infusión adecuado |
|
|
3.- Penetración adecuada en el órgano diana |
|
c.- |
Elección |
|
|
1.- Según la exposición previa a otros agentes |
|
|
2.- Según las comorbilidades presentes |
|
|
7.1 ¿Cuándo iniciar el tratamiento antibiótico?
El momento de inicio de la terapia
antibiótica es crucial en el tratamiento de los pacientes sépticos. Un retraso en
la administración del antibiótico adecuado se ha asociado con una mayor mortalidad
[25, 71-74].
En un estudio prospectivo [74]
el tratamiento antibiótico inadecuado fue el factor de riesgo más importante
para la mortalidad hospitalaria (OR: 4,26; IC95%:
3,3-5,4
[p<0,001]). Garnacho-Montero y col. [72] mostraron que la administración
de tratamiento antibiótico inadecuado fue responsable de la evolución
de pacientes con sepsis grave a shock séptico en más de un 50% de
los casos. El impacto
del tratamiento antibiótico adecuado sobre la supervivencia es mayor cuanto más
grave está el paciente: la supervivencia aumentó en un 20%
en los
pacientes con sepsis y en un 49% en los pacientes con shock séptico. Estos
datos fueron confirmados por otros autores [75],
y son sustancialmente superiores a los alcanzados por otras modalidades de
tratamiento coadyuvante [76,
77] (Figura 3).
Figura 3: Incremento de la supervivencia en pacientes
con sepsis grave según se administre antibióticos adecuados [72], proteína
C activada humana recombinante [76] o corticoides [77]
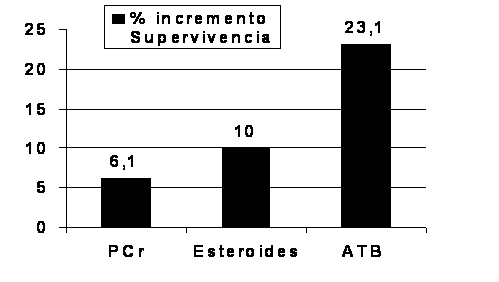
7.2 ¿En qué dosis?
En los pacientes críticos resulta
también de mucha importancia, administrar la
dosis correcta del
antibiótico. El
estado de respuesta inflamatoria sistémica (SRIS) que desencadena la
sepsis, junto al elevado aporte de fluidos (necesarios para la
estabilización hemodinámica) y el empleo de VM, se asocian a un
incremento en el volumen de distribución que puede ser superior al
50% [78]. Como resultado de ello, tanto la concentración pico como la vida
media de los antibióticos disminuyen respecto de los valores esperados en
pacientes no críticos [78]. La principal causa de aparición de resistencia
de los patógenos y de fallo en la terapéutica es la utilización de dosis
subóptimas de antibiótico. Estos efectos adversos en los pacientes críticos
pueden minimizarse utilizando un incremento de la dosis habitual para
agentes en los cuales la actividad depende de la concentración alcanzada
(PK/PD), como son las fluoroquinolonas y los aminoglucósidos [79]. En cambio, los
antibióticos beta-lactámicos o la vancomicina son tiempo-dependientes,
es decir, su acción se logra cuando la concentración sérica se mantiene
por encima de la concentración inhibitoria mínima (CIM) por un 40% del
tiempo. Este tipo de agentes puede requerir una infusión continua para
mantener concentraciones por encima de la CIM en los pacientes críticos.
Nuestro protocolo de administración de vancomicina en la NAV por
SARM está
basado en la administración de 15 mg/kg en una hora seguido de 30 mg/kg en infusión las 24 horas. La dosis se ajusta para mantener niveles séricos de
vancomicina entre 20-30 mcg/ml [44]. Recientemente, se ha recomendado un
tiempo de infusión más prolongado (superior a 3 horas) para la administración de
carbapenem [80].
Sin embargo, adecuar la dosis no
asegura que el agente logre la concentración adecuada en todos los tejidos.
La pobre penetración de los antibióticos en tejidos infectados se asocia a fracaso
terapéutico. La escasa penetración de la vancomicina en el pulmón ha sido
evaluada por varios autores [81, 82], evidenciando que los niveles de
vancomicina en el tejido pulmonar fueron inferiores a la CIM para S.
aureus
a las dosis habituales, y que luego de 5 días de tratamiento, la
concentración de vancomicina en el líquido epitelial (LE) fue menor
de 4 mg/kg en
el 36% de los pacientes, con una relación plasma/LE de penetración de 6 a
1. En 1994, Rello y col. [23] comunicaron una mortalidad sustancialmente
mayor dentro de los pacientes con NAV por SARM (54%) (a pesar de ser
tratados con vancomicina), comparada con la mortalidad de la NAV por
SASM
(2,6%), que recibieron cloxacilina. Posteriormente, estos datos fueron
confirmados por González y col. [83], quienes observaron una mortalidad
similar a la informada por Rello y col. [23] para los pacientes con neumonía
bacteriémica por
SARM tratados con vancomicina. Pero llamativamente, los
pacientes con NAV por
SASM presentaron una mortalidad significativamente
mayor cuando fueron tratados con vancomicina en lugar de cloxacilina (47%
frente a 0%, p < 0,01). Estos datos sugieren que la administración de vancomicina
para el tratamiento de la neumonía por cocos Gram positivos se asocia a
mal pronóstico [44], por lo que, si es posible, la vancomicina no debe ser
considerada como un agente de primera línea en el tratamiento de la NAV.
Se han desarrollado nuevos fármacos [84],
que pueden ofrecer una mejor opción terapéutica para
estos pacientes.
7.3 ¿Con qué agente empezamos?
Sin lugar a dudas, la elección del
antibiótico debe estar relacionada con la
institución y con las particularidades
del paciente. Nosotros recomendamos [40, 44] iniciar la terapia empírica con
antibióticos de amplio espectro para pacientes con sospecha de NAV, y luego realizar una reevaluación del plan antibiótico de acuerdo a los resultados de
microbiología, enfatizando la necesidad de realizar desescalamientos
del espectro cuando esto sea posible a fin de
reducir la presión de
selección [3]. Una
reciente conferencia internacional de consenso [70]
concuerda en que se debe implementar una terapia combinada de
antibióticos en la
NAV de comienzo tardío donde se sospeche la participación de P.
aeruginosa o
SARM.
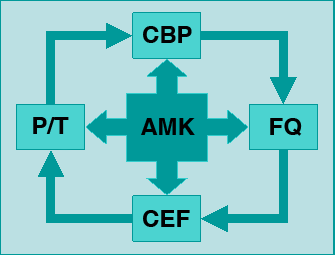
Es difícil decidir la opción inicial
en pacientes que recibieron antibióticos previos. Un nuevo agente
antibiótico puede tener
mecanismos cruzados de resistencia con antibióticos previos. Es probable que los
pacientes que han recibido beta-lactámicos hayan desarrollado resistencia
a esos agentes, por lo cual un carbapenem pueden ser una buena opción de
inicio. Si en cambio, el paciente recibió este grupo de antibiótico (carbapenem),
las fluoroquinolonas (p.ej: ciprofloxacina) pueden ser empleadas como
opción de cambio. Sin embargo, si el paciente recibió quinolonas, los
carbapenem no se deben emplear, por la posibilidad de resistencia cruzada
[44]. En este último caso,
piperacilina/tazobactam puede ser una opción razonable. En la Figura 4 se
esquematiza nuestro esquema de elección del antibiótico inicial en pacientes que
reciben antibióticos.
Figura 4: Elección del
antibiótico inicial basada en la exposición previa del paciente a
antibióticos. La amikacina (AMK) funciona como antibiótico de combinación
en los casos que lo requieren. CBP: Carbapenem; FQ: Fluoroquinolonas; CEF:
Cefalosporinas de tercera o cuarta generación; P/T: Piperacilina/Tazobactam
(Modificado de [44]).
7.4 ¿Qué
microorganismos deben estar cubiertos?
Los principales factores de riesgo
que pueden determinar la presencia de un agente se han mencionado en el
apartado etiología y en la Tabla IV. Puntualmente describiremos que:
En pacientes que desarrollan NAV
precoz en ausencia de antibióticos previos,
los microorganismos que se aíslan con más frecuencia son:
H. influenzae, SASM,
S. pneumoniae y enterobacterias.
P.
aeruginosa es frecuente en
pacientes con EPOC, en pacientes en ventilación mecánica
durante más de 7 días y
tras la exposición previa a
antibióticos.
SARM es común en pacientes con
ingresos prolongados y
antibióticos previos. Además se deberá sospechar en
situaciones endémicas.
Acinetobacter spp. es frecuente en
condiciones de mal manejo de la vía aérea y en áreas de alta presión de
colonización.
Candida spp. no debe ser considerada
como patógeno en pacientes no neutropénicos.
7.5 ¿Qué duración
debe tener el tratamiento antibiótico?
La duración del tratamiento es un
tema debatido ampliamente, con poco nivel de evidencia científica y con
recomendaciones que surgen del consenso de expertos. Las guías de la ATS
[37] recomiendan una duración variable del tratamiento
según el microorganismo que se considere, entre 7-14 días para
SASM y H. influenzae,
mientras que para P. aeruginosa,
Acinetobacter spp. o neumonía necrotizante
por Gram negativos ese período se extiende hasta 21 días. Se
han utilizado
cursos más cortos de antibióticos con la finalidad de reducir la utilización de
antibiótico,
disminuir los costos y evitar la aparición de resistencias [63].
Por otra parte, se emplean periodos prolongados para intentar evitar la
recurrencia de los episodios de NAV. Sin embargo, esta actitud selecciona
cepas resistentes, incrementa el riesgo de efectos adversos y por supuesto
los costos, sin prevenir las recurrencias [45].
Nuestro grupo utiliza períodos cortos de antibióticos administrados a
dosis altas, dependiendo de la farmacocinética de los agentes
y de su penetración tisular [44].
Los antibióticos se
suspenden a las 72 horas de lograr una resolución
clínica (desaparición de la fiebre y cambios favorables en las
características de las secreciones con mejoría de la oxigenación), siendo
ésta una conducta estrechamente ligada a las características particulares
del paciente y al microorganismos responsable.
7.6 ¿Qué resultados
de microbiología pueden determinar cambio de antibióticos?
Como hemos comentado, la información
microbiológica puede resultar de mucha ayuda para elegir el tratamiento
inicial, y sobre todo para modificarlo
después, mejorando la relación costo/efectividad
del mismo. La posibilidad de realizar una
reducción del espectro del
antibiótico según los resultados de los cultivos de las muestras obtenidas
precozmente, contribuye fuertemente a evitar el desarrollo de
multirresistencia.
Sin embargo, no hay mucha evidencia
disponible para valorar el verdadero impacto de esta conducta en la NAV.
Rello y col. [25] evidenciaron un nivel de
desescalación del 6,1% en una UCI con
elevada presión de colonización por P.
aeruginosa. Este nivel de desescalación se incrementó de forma sustancial en un área con menor presión de
colonización, llegando hasta el 38% [3]. La frecuencia
de desescalación fue superior
en los pacientes con NAV precoz (40%) respecto de la NAV tardía (12%), y está asociada con el espectro inicial del tratamiento, con la incidencia
de microorganismos potencialmente resistentes y con la frecuencia de
etiologías desconocidas. Estos hallazgos sugieren que la obtención de
muestras apropiadas para su cultivo antes de iniciar el tratamiento
antibiótico es
fundamental para modificar (y muchas veces reducir el espectro) el
tratamiento empírico inicial.
La NAV es una entidad frecuente en
la UCI, la mortalidad se relaciona estrechamente con el
antibiótico
inadecuado,
cuya incidencia se mantiene inexplicablemente elevada. Ante la sospecha de
NAV en un paciente crítico proponemos unas simples reglas (fáciles de
recordar), que resumen la esencia de nuestro programa de manejo de la NAV
[44]:
“Golpea duro”: con el antibiótico de mayor espectro
necesario
“Ve al grano”: utiliza el antibiótico de acuerdo a su
farmacodinamia para lograr una concentración tisular efectiva
“Focaliza, focaliza”: Disminuye el espectro cuando
sea posible según los resultados de microbiología, y no prolongues
innecesariamente el antibiótico.
“Escucha a tu hospital”: Utiliza los
antibióticos de acuerdo
con la información actualizada de los patrones de sensibilidad de los
patógenos de tu unidad.
“Mira a tu paciente”: Individualiza la terapia inicial según las comorbilidades, la exposición previa a antibióticos y
la duración de
la ventilación mecánica.
-
Vincent JL,
Bihari DJ, Suter PM et al. The prevalence of nosocomial infection in
intensive care units in Europe: Results of the European Prevalence of
Infection in Intensive Care (EPIC) study. JAMA 1995;
274: 639-644.
-
Troullliet
JL, Chastre J, Vuagnat A, et al . Ventilator-associated pneumonia caused
by potentially drug-resistant bacteria. Am J Respir Crit Care Med 1998;
157: 531-539.
-
Rello J,
Vidaur L, Sandiumenge A y col. De-escalation therapy in
associated-ventilator pneumonia. Crit Care Med 2004 ( in press)
-
Rello J,
Impact of nosocomial infections on outcome: Myths and evidence. Infect
Control Hosp Epidemiol 1999; 20:
392-394.
-
Rello J,
Díaz E. Pneumonia in the intensive care unit. Crit Care Med 2003; 31:
2544-2551.
-
Richards
MJ, Edwards JR, Culver DH y col. Nosocomial infections in medical
intensive care unit in the Unit States. National Nosocomial Infections
Surveillance System . Crit Care Med 1999; 27:
887-892.
-
Kollef MH.
Ventilator-associate pneumonia : A multivariate analysis. JAMA 1993;
270: 1965-1970.
-
National
Nosocomial Infections (NNIS) System: Data summary from Jan 1992-june
2001. Am J Infect Control 2001; 29:
408-421.
-
Rello J,
Díaz E, Roque M y col. Risk factors for developing pneumonia within 48
hs of intubation. Am J Respir Crit Care Med 1999;
159: 1742-1746.
-
Cook D,
Walter S, Cook R y col. Incidence and risk for associated-ventilator
pneumonia in critically ill patients. Ann Inter Med 1998;
129: 433-437.
-
Rodríguez
A, Rello J. Neumonía asociada a la ventilación mecánica. En PROATI (ciclo
3), capítulo 9, 1999 Editorial Médica Panamericana.
-
Rello J,
Ollendorf DA, Oster G y col. Epidemiology and outcomes of
ventilator-associated pneumonia in a large US database. Chest 2002;
122: 2115-2112.
-
Hubmayr
RD: Statement of the 4th International Consensus conference in critical
care on ICU-acquired pneumonia. Intensive Care Med 2002; 28: 1521-1536.
-
Fein A,
Grossman R, Ost D et al. Diagnosis and management of pneumonia and other
respiratory infections. En Professional Communications, Inc. 2nd Ed.
2000, 125.
-
Rodriguez
A, Rello J. Mortalidad atribuible en la neumonía asociada a
ventilación mecánica. ¿Mito o realidad?. Med Intensiva 2002; 18: 6-8.
-
Joshi N,
Localio AR, Armony BH. A predictive risk index for nosocomial pneumonia
in the intensive care unit. Am J Med 1992; 93:
135-142.
-
Fagon JY,
Chastre J, Hance AJ, et al. Nosocomial pneumonia in ventilated patients:
A cohort study evaluating attributable mortality and hospital stay. Am J
Med 1993; 94: 281-288.
-
Leu HS,
Kaiser DL, Mori M et al. Hospital-acquired pneumonia. Attributable
mortality and morbidity. Am J Epidemiol 1989; 93:
135-142.
-
Rello J,
Vallés J. Observations on mortality from hospital-acquired pneumonia.
Infect Contr Hosp Epidemiol 1998; 19:
775-797.
-
Rello J,
Rue M, Jubert P y col. Survival in patients with nosocomial pneumonia:
Impact of the severity of illness and the etiologic agent. Crit Care Med
1997; 25: 1862-1867.
-
Girou E,
Sthephan F, Novara A et al. Risk factors and outcome of nosocomial
infections: Results of a matched case-control study of ICU patients. Am
J Respir Crit Care Med 1998; 157:
1151-1158.
-
Rello J,
Jubert P, Vallés J et al. Evaluation of outcome for intubated patients
with pneumonia due to Pseudomonas aeruginosa. Clin Infect Dis 1996; 23:
973-978.
-
Rello J,
Torres A, Ricart M et al. Ventilator-associated pneumonia by
Staphylococcus aureus :Comparison of methicillin-resistant with
methicillin-sensitive episodes. AM J Respir Crit Care Med 1994; 150:
1545-1549.
-
Luna CM,
Vujacich P, Niederman MS et al. Impact of BAL data on the therapy and
outcome of ventilator-associated pneumonia. Chest 1997;
111: 676-685.
-
Rello J,
Gallego M, Mariscal D et al. The value of routine microbiological
investigation in ventilator-associated pneumonia. Am J Respir Crit Care
Med 1997; 156:
19-200
-
regui M,
Ward S, Sherman G et al. Clinical importance of delays in the initiation
of appropriate antibiotic treatment for ventilator-associated pneumonia.
Chest 2002; 122: 262-268.
-
Alvarez-Lerma
F. Modification of empiric antibiotic therapy in patients with
pneumonia acquired in the intensive care unit. Intensive Care Med 1996;
22: 387-394.
-
Dupont H,
Mentec H, Sollet JP et al. Impact of appropriateness of initial
antibiotic therapy on the outcome of ventilator-associated pneumonia.
Intensive Care Med 2001; 27:
355-362.
-
Dreyfuss
D, Djedaini K, Gros I et al. Mechanical ventilation with heated
humidifiers and head moisture exchangers: Effects on patient
colonization and incidence of nosocomial pneumonia. Am J Respir Crit
Care Med 1995; 151:
540-542.
-
Craven DE,
Kunches LM, Klinski V et al. Risk factors for pneumonia and fatality in
patients receiving continuous mechanical ventilation. Am Rev Respir Dis
1986; 133: 792-796.
-
Heyland DK,
Cook D, Doded PM. Prevention of ventilator-associated pneumonia. Current
practice in Canadian intensive Care Units. J Crit Care 2002;
17: 161-167.
-
Thomachot
L, Leone M, Razzouk K et al. Randomized clinical trial of extended use
of a hydrophobic condenser humidifier: 1 vs 7 days. Crit Care Med 2002;
30: 232-237.
-
Orozco-Levi M, Torres A, Ferrer M et al. Semi-recumbent position
protect from pulmonary aspiration but not completely from
gastroesophageal reflux in mechanical ventilated patients. Am J Respir
Crit Care Med 1995; 152: 1387-1390.
-
Vallés J,
Artigas A, Rello J, et al. Continuous aspiration of subglottic secretion
in preventing ventilator-associated pneumonia. Ann Intern Med 1995;
122: 229-231.
-
Rello J,
Soñora R, Jubert P et al. Pneumonia in intubated patients : role of
respiratory airway care. Am J Respir Crit Care Med 1996;
154: 111-115.
-
Olson ME,
Harmon BG, Kollef MH: Silver-coated endotracheal tubes associated with
reduced bacterial burden in the lung of mechanical ventilated dogs.
Chest 2002; 121: 863-870.
-
American
Thoracic Society: Hospital adquired pneumonia in ventilated pacients.
Diagnosis assessment of severity, initial antimicrobial therapy and
preventative strategies. Am J Respir Crit Care Med 1995; 153: 1711-1725.
-
Rello J,
Sa-Borges M, Correa H et al. Variations in etiology of ventilator
associated pneumonia around four treatment sites: Implications for
antimicrobial prescribing practices. Am J Respir Crit Care Med 1999;
160: 608-613.
-
Namias J,
Samiian L, Nino D et al. Incidence and susceptibility of pathogenic
bacteria vary between ICU within a single hospital : Implications for
empiric antibiotic strategies . J Trauma 2000;
49: 638-645.
-
Vidaur L,
Rodríguez A, Rello J. Antibiotic therapy for sepsis, severe sepsis and
septic shock: The “Tarragona” Strategy. En Yearbook of Intensive Care
and Emergency Medicine. J-L Vincent (ed) Springer 2004, pp 229-241.
-
brahim EH,
Ward S, Shernan G et al. A comparative analysis of patients with
early-onset vs late-onset nosocomial pneumonia in ICU setting. Chest
2000; 177: 1434-1442.
-
Rello J,
Díaz E, Rodríguez A. Etiology of ventilator-associated pneumonia.
Seminar Respir Infect 2005 ( in press)
-
Rello J,
Ausina V, Ricart M et al. Impact of previous antimicrobial therapy on
the etiology and outcome of ventilator-associated pneumonia. Chest
1993: 104: 1230-1235.
-
Sandiumenge A, Díaz E, Bodi M et al. Treatment of ventilator-associated
pneumonia: A patient-based approach based on the ten rules of “the
Tarragona Strategy”. Intensive Care Med 2003;
29: 876-883.
-
Rello J,
Mariscal D, March F et al. Recurrent Pseudomonas aeruginosa pneumonia in
ventilated patients: Relapse or reinfection?. Am J Respir Crit Care Med
1998; 157: 912-916.
-
Rello J,
Ausina B, Ricart M et al. Risk factor for infection by Pseudomonas
aeruginosa in patients with ventilator-associated pneumonia. Intensive
Care Med 1994; 20:
193-198.
-
Cortes P,
Mariscal D, Vallés J et al. Presence of polyclonal Pseudomonas
aeruginosa in an intensive care unit: a 27-month prospective study on
molecular epidemiology. Infect Control Hospit
Epidemiol 2001; 22:
720-723.
-
Garnacho
J, Solé-violan J, Sa-Borges ; et al. Clinical impact of pneumonia caused
by Acinetobacter baumannii in intubated patients. A matched cohort
study. Crit Care Med 2003; 31: 2478-2482.
-
Rello J,
Díaz E. Acinetobacter baumannii: a threat for the ICU?. Intensive Care
Med 2003; 29: 350-351.
-
Berk S,
Verghese A. Emerging pathogens in nosocomial pneumonia. Eur J Clin
Microbiol Infect Dis 1989; 8: 1-14.
-
Gallego M,
Rello J : Diagnostic testing for ventilator-associated pneumonia . Clin
Chest Med 1999; 20:
671-679.
-
Nseir S,
Di Pompeo C, Soubrier S et al. Outcome of ventilated COPD with
nosocomial tracheobronchitis: a case-control study. Infection 2004;
32: 210-216.
-
Hamer DH.
Treatment of nosocomial pneumonia and tracheobronchitis caused by
multidrug-resistant Paseudomonas aeruginosa with aerosolized colistin.
AM J Respir Crit Care Med 2000; 162:
328-330.
-
Mabie M,
Wunderink RG. Use and limitation of clinical and radiologic diagnosis of
pneumonia. Semin Respir Infec 2003; 18:
72-79.
-
Wunderink
R, Woldenberg L, Zeiss J et al. Radiologic diagnosis of autopsy-proven
ventilator-associated pneumonia. Chest 1992;
101: 458-463.
-
Winer-Muram HT, Rubin SA, Ellis JV et al. Pneumonia and ARDS in patients
receiving mechanical ventilation : Diagnostic accuracy of chest
radiography. Radiology 1993; 188: 479-485.
-
Wunderink
R. Value of radiological findings for suspecting and diagnosing
ICU-acquired pneumonia. International Consensus Conference in intensive
care medicine ICU-acquired pneumonia. 2001, september 13-14. Chicago,
IL.USA
-
Pugin J,
Auckentaler R, Mili N et al. Diagnosis of ventilator-associated
pneumonia by bacteriologic analysis of bronchoscopic and
nonbronchoscopic “blind” brochoalveolar lavage fluid. Am Rev Respir Dis
1991; 143: 1121-1129.
-
Flanagran
PG, Findlay GP, Magee JT et al. The diagnosis of ventilator-associated
pneumonia. Intensive Care Med 2000; 26:
20-30.
-
Papazian
L, Thomas P, Garbe L et al. Bronchoscopic or blind sampling techniques
for the diagnosis of ventilator-associated pneumonia. Am J Respir Crit
Care Med 1995; 152:
1982-1991.
-
Fabregas
N, Ewig S, Torres A et al. Clinical diagnosis of ventilator-associated
pnuemonia revisited: Comparative validation using immediate post-mortem
lung biopsies. Thorax 1999; 54: 867-873.
-
Luna CM,
Blanzaco D, Niederman M et al. Resolution of ventilator-associated
pneumonia: prospective evaluation of the clinical pulmonary infection
score as an early clinical predictor of outcome. Crit Care Med 2003;
31: 676-682.
-
Singh N,
Rogers P, Atwood CW et al. Short-course empiric antibiotic therapy for
patients with pulmonary infiltrates in the intensive care unit: A
proposed solution for indiscriminate antibiotic prescription. Am J
Respir Crit Care Med 2000; 162:
505-511.
-
Mayhall
CG: Nosocomial Pneumonia. Diagnosis and prevention. Infectious Diseases
Clinics of North America 1997; 11:
427-451.
-
Grossman
RF, Fein A: evidence-based assessment of diagnostic test for the
diagnosis of ventilator-associated pneumonia. Chest 2000;
117: 177S-181S.
-
Timsit JF,
Chevret S, Valcke J et al. Mortality of nosocomial pneumonia in
ventilated patients: Influence of diagnostic tools. Am J Respir Crit
Care Med 1996; 154:
116-123.
-
Fagon
JY, Chastre J, Wolff M et al. Invasive and noninvasive strategies for
management of suspected ventilator-associated pneumonia. Ann Intern Med
2000; 132: 621-630.
-
Mertens
AH, Nagler JM, Galdermans DI et al. Quality assessment of protected
specimen brush samples by microscopic cell count. Am J Respir Crit Care
Med 1998; 156: 1240-1243.
-
Morris AJ,
David CT, Reller LB. Rejection criteria for endotracheal aspirates from
adults. J Clin Microbiol 1993; 31:
1027-1029.
-
Rello J,
Paiva A, Baraibar J et al. International conference for the development
of consensus on the diagnosis and treatment of ventilator-associated
pneumonia. Chest 2001; 120:
955-970.
-
Luna CM,
Vujacich P, Niederman M et al. Impact of BAL data on the therapy and
outcome of ventilator-associated pneumonia. Chest 1997;
111: 676-685.
-
Garnacho-Montero
J, García-Garmendia JL, Barrero Almodovar AE et al. Impact of adequate
antibiotic therapy the outcome in patients admitted to the ICU with
sepsis. Crit Care Med 2003; 31:
2742-2751.
-
Rello J,
Rodriguez A. Improving survival for sepsis. On the cutting edge. Crit
Care Med 2003; 31:
2807-2808.
-
Kollef MH,
Sherman G, Ward S , Fraser VJ. Inadequate antimicrobial treatment of
infections. A risk factor for hospital mortality among critically ill
patients. Chest 1999; 115: 462-474.
-
Vallés J,
Rello J, Ochagavía A et al. Community-acquired bloodstream infection in
critically ill adult patients. Impact of shock and inappropriate
antibiotic therapy on survival. Chest 2003;
123: 1615-1624.
-
Bernard GR,
Vincent JL, Laterre PF et al. Efficacy and safety of recombinant human
activated protein C for severe sepsis. NEJM 2001;
344: 699-709.
-
Annane D,
Sébille V, Charpentier C et al. Effects of a treatment with low doses of
hydrocortisone and fludrocortisone on mortality in patients with septic
shock. JAMA 2002; 288:
862-971.
-
Fry DE.
The importance of antibiotic pharmacokinetics in critical illness. AM J
Surg 1996; 172 (suppl
6A): 20S-25S.
-
Schentag
JJ; Gilliand KK, Paladino JA. What have we learned from pharmacokinetic
and pharmacodynamic theories). Clin Infect Dis 2001;
32 (suppl
1): S39-S46.
-
Drusano
GL. Prevention of resistance: A goal for dose selection for
antimicrobial agents. Clin Infect Dis 2003; 36
(suppl 1): S42-S50.
-
Cruciani
M, Gatti G, Lazzarini L et al. Penetration of vancomycin into human lung
tissue . J Antimicrob Chemother 1996; 38:
865-869.
-
Lamer C,
de Beco V, Soler P et al. Analysis of vancomycin entry into pulmonary
lining fluid by bronchoalveloar lavage in critically ill patients.
Antimicrob Agents Chemother 1993; 37: 281-286.
-
González
C, Rubio M, Romero-Vivas J, et al. Bacteremic pneumonia due to
Staphylococcus aureus: A comparison of disease caused by methicillin-resistant
and methicillin-susceptible organisms. Clin Infect Dis 1999;
29: 1171-1177.
-
Kollef MH,
Rello J, Cammarata SK et al. Clinical cure and survival in Gram-positive
ventilator-associated pneumonia: retrospective analysis of two
double-blind studies comparing linezolid with vancomycin. Intensive Care
Med 2004; 30: 388-394.
Jordi Rello Condomines
Hospital Universitario Joan XXIII, Tarragona
©REMI,
http://remi.uninet.edu. Octubre 2004.
Palabras clave:
Neumonía asociada a ventilación mecánica, Tratamiento antibiótico,
Política de antibióticos.
Busque en REMI con Google:
Envía tu comentario para su
publicación |