|
La Medicina, como ciencia inexacta que es,
maneja conceptos claramente relacionados con la probabilidad. Esta
inexactitud se refleja incluso en sus principios más primarios como son
los conceptos de salud y enfermedad, precisándose para establecer éstos de
puntos de vista sociales, culturales e incluso personales.
La definición de “salud” emitida por la
Organización Mundial para la Salud (OMS), en la que se describe como el
estado de bienestar físico, psíquico y social, no hace más que confirmar
esta opinión de que son múltiples los factores que intervienen en cada uno
de los actos de nuestra profesión sanitaria, y que esta percepción de
bienestar es muy relativa y difícilmente exportable de una situación
socio-cultural a otra, o incluso de una persona a otra en una misma
comunidad.
Ejercer la Medicina de una forma efectiva y
eficiente requiere, además de una adecuada formación teórica y técnica,
una especial sensibilidad personal para la interpretación de la
información que nos transmite el paciente y su entorno. Esta sensibilidad
o “Arte de la Medicina” permite tomar decisiones en un contexto de
inexactitud e incertidumbre, y en este contexto intentar curar o mejorar
al paciente.
Estas consideraciones cobran especial
importancia en el momento en que las decisiones deben ser tomadas
basándose en un relativo desconocimiento del paciente, sobre unos
presupuestos de cortedad de tiempo, y en un ambiente de angustia personal,
tanto del paciente como del médico. Esto es, en situaciones de urgencia o
emergencia tan frecuentes en los pacientes críticos.
Cuando lo que se pretende es definir la
“gravedad”, la situación se complica mucho más, ya que este concepto
todavía es más impreciso y subjetivo, interviniendo multitud de factores
relacionados con el mismo, como son: el riesgo vital, la intensidad de la
agresión, la repercusión de la misma, el esfuerzo terapéutico necesario
para su control, las probabilidades de recuperación, su pronóstico, etc.
Incluso difiere la percepción de gravedad entre niveles formativos
semejantes (no es igual la percepción de gravedad que puede tener un
rehabilitador, un oncólogo o un intensivista).
A estos conceptos imprecisos y subjetivos se
añade un factor fundamental en la medicina actual, la relación directa
entre la gravedad de un proceso y los recursos sanitarios necesarios para
su atención. En una época marcada por el economicismo sanitario y la
necesidad de aplicar unos instrumentos de gestión que puedan adecuarse a
la búsqueda de la efectividad, la eficacia y la eficiencia, bajo un
paraguas de calidad asistencial, se debe el enorme desarrollo
experimentado por lo que se ha llamado la “Teoría del Pronóstico”
establecido a través de criterios objetivos de gravedad [1]. Esto ha sido
especialmente cierto en el campo de la Medicina Intensiva, donde la
incorporación de los índices de gravedad y sus derivados, los índices
pronósticos [2, 3] constituyen un campo de investigación permanente.
La visión subjetiva y difusa de la
enfermedad y su gravedad ha dejado paso progresivamente a las definiciones
consensuadas, a criterios clínico-biológicos definidos y a complejos
procesos matemáticos que permiten establecer índices de gravedad
objetivos y estimaciones pronósticas basadas en datos uniformados y
comparables entre poblaciones similares. En definitiva en instrumentos de
gestión, instrumentos de comunicación objetivos y en un buen instrumento
de control de calidad.
|
2. Valoración
de la gravedad en la sepsis |
Al igual que un gran número de patologías,
la infección es únicamente un factor de agresión, relativamente
independiente de la repercusión que ésta tiene en el paciente. “No son
las enfermedades las que matan a las personas, sino la repercusión que
éstas tienen sobre el conjunto del organismo y sus funciones” (W.
Osler - siglo XIX).
Esta repercusión va a estar mediatizada por
varios factores dependientes del agente agresor y de las características
del paciente. Es fácil entender esto con un ejemplo: una neumonía
extrahospitalaria en un paciente joven, sin patologías asociadas, no
fumador y deportista no representará la misma gravedad que la misma
neumonía, por el mismo microorganismo y con la misma extensión en un
paciente anciano, EPOC, diabético insulinodependiente con mal control
metabólico y afecto de una hemiplejía residual con atrofia muscular
homolateral a la neumonía. Probablemente el primer paciente pueda ser
tratado ambulatoriamente y presentar una evolución favorable, mientras que
el segundo paciente probablemente requerirá medidas de soporte
ventilatorio y tendrá altas posibilidades de fallecer por dicha patología
pese a los esfuerzos terapéuticos aplicados. De forma similar, un mismo
microorganismo puede representar patologías infecciosas de gravedad y
pronóstico claramente diferentes, así una sinusitis por S. pneumoniae
suele ser una patología relativamente fácil de controlar y con escasa
repercusión sistémica, pero si el mismo microorganismo penetra por
contigüidad en el sistema nervioso central y provoca una meningoencefalitis
bacteriana, la gravedad del cuadro y su afectación global son radicalmente
diferentes en el mismo paciente.
Si como se ha comentado en el apartado
anterior, definir la enfermedad es complejo, en la sepsis esto ha sido
igualmente confuso, lo que ha impedido la realización de estudios con la calidad
suficiente como para permitir obtener conclusiones validables.
Históricamente se han empleados términos diferentes para definir
situaciones similares, o por el contrario términos excesivamente ambiguos
que englobaban posibilidades clínico-biológicas muy dispares, y que
únicamente han aportado confusión y mala estratificación de los pacientes
y su gravedad. Términos como síndrome séptico, septicemia, shock séptico,
etc., carecían de definiciones precisas, y por tanto su utilización ha sido
sistemáticamente empleada con unos criterios claramente subjetivos.
En 1991 se desarrolló una conferencia de
consenso [4] con el objetivo de establecer unas definiciones
internacionales del proceso séptico y sus diferentes niveles de gravedad,
fundamentalmente basadas en términos de afectación orgánica.
De esta conferencia de consenso salieron
definiciones para términos como Infección, Síndrome de Respuesta
Inflamatoria Sistémica (SRIS), Sepsis, Sepsis Grave y Shock Séptico. Estas
definiciones tampoco son perfectas, y han motivado infinidad de
comentarios bibliográficos [5], e incluso la convocatoria de una nueva
conferencia de consenso de la que se extrajeron algunos cambios
conceptuales y matizaciones de los términos relacionados con la sepsis y
su gravedad [6], pero que intrínsecamente expresan un abanico continuo de
gravedad de la enfermedad infecciosa en función de su repercusión sobre
las distintas funciones orgánicas, con morbilidad y mortalidad
progresivamente mayores.
En el año 2002 se introdujo el sistema PIRO
[7] como una nueva visión de la sepsis y sus factores pronósticos en base
a cuatro conceptos (PIRO): premorbilidad (P), infección (I), respuesta del
huésped (R) y disfunción de órganos (O). Este sistema intenta clasificar
la sepsis de modo similar al TNM utilizado para las neoplasias,
permitiendo la caracterización de un determinado caso y facilitando su
pronóstico:
La Predisposición (P) del paciente
condiciona de forma notoria su posible evolución desfavorable. Hay
evidencia de la existencia de factores genéticos que condicionan una mayor
mortalidad en la sepsis [8]. La presencia de polimorfismos genéticos
condiciona una respuesta más agresiva a la sepsis, con mayor reacción
inflamatoria y mayor riesgo de muerte. Del mismo modo, la presencia de
patología subyacente o enfermedades coexistentes son factores asociados
con clara repercusión sobre la respuesta del huésped.
La Infección (I), dependiendo del
agente patógeno causal, la cantidad de inóculo, su localización y su
extensión, tienen claramente una influencia sustancial en la evolución del
paciente. Circunstancias asociadas a ella como el retraso en la
implantación de un tratamiento antibiótico eficaz [9] o el error en la
selección de la antibioterapia empírica [10] pueden contribuir a la
mortalidad asociada a la sepsis.
La Respuesta (R) del organismo en
forma de liberación de mediadores de la inflamación (proinflamatorios y
moduladores de la inflamación) condicionará, en función del disbalance que
pueda producirse entre unos y otros una reacción sistémica conocida como
SRIS. Esta reacción inflamatoria desproporcionada y sostenida puede
conducir progresivamente a la disfunción y al fracaso multiorgánico, con
altas probabilidades de muerte. Una buena parte de los esfuerzos
terapéuticos actuales están dirigidos a controlar esta respuesta endógena
patológica [11-12] como complemento a las medidas habituales utilizadas en
el tratamiento de la sepsis.
La Disfunción Orgánica (O) es el
principal factor determinante de la evolución del paciente y probablemente
marcador del pronóstico final [13]. El número de órganos disfuncionantes o
en fallo no solo supone un mayor consumo de recursos y esfuerzo
terapéutico, sino que claramente es la expresión del impacto que sobre el
organismo ha tenido el proceso infeccioso o su respuesta patológica. La
evolución de estos fracasos orgánicos tras el tratamiento de la sepsis,
hacia la recuperación o hacia el deterioro, se relaciona con el pronóstico
final del paciente [14].
Esta novedosa clasificación de la enfermedad
séptica presenta como problema su complejidad, derivada del intento de ser
muy completa, siendo esto todavía más importante cuando el proceso que se
intenta clasificar es tan cambiante en poco tiempo como la sepsis. Por
ello su aceptación ha sido de momento escasa y su utilización no se ha
difundido en nuestro medio.
Así pues, el fenómeno séptico no debe
simplificarse al hecho de la injuria microbiana, debe ser considerado como
una constelación de factores interrelacionados entre los que figuran
factores dependientes del huésped y factores dependientes del agente
agresor. Unidos todos ellos podremos tener una visión global del problema
con el que nos enfrentamos y optar a medidas dirigidas a su lucha desde
diversas perspectivas: terapia genética, profilaxis vacunal, tratamientos
antibióticos, moduladores de la respuesta inflamatoria y medidas de
soporte orgánico.
|
3. Estratificación
y predicción en los pacientes con sepsis grave |
Como base fundamental para obtener
resultados válidos en estudios científicos es preciso establecer
previamente los conceptos y definiciones con las que vamos a trabajar, con
el objetivo de que los resultados obtenidos sean comparables con otras
series propias o de otros centros investigadores.
Desde la conferencia de consenso podemos
uniformizar los conceptos evolutivos y de gravedad del proceso infeccioso,
pudiéndose obtener ya resultados comparativos en estudios multicéntricos y
establecer con una fiabilidad razonable conclusiones validables sobre
estimaciones pronósticas y medidas terapéuticas.
El primer paso en la estratificación del
riesgo en la patología infecciosa surge de la misma conferencia de
consenso, considerando los distintos estadios como fases diferenciales de
gravedad y afectación orgánica del huésped. Así, es sencillo establecer un
primer pronóstico grosero estratificando al paciente en uno de los cuatro
posibles estadios del proceso agresor: SRIS, sepsis, sepsis grave y shock
séptico, que presentarán mortalidades aproximadas del 7%, 16%, 20% y 46%
respectivamente [15].
SRIS (Síndrome de Respuesta Inflamatoria Sistémica) :
Corresponde al estado de reacción orgánica ante una agresión infecciosa o
no. La respuesta del organismo a la agresión mediante la liberación de
mediadores pro y antiinflamatorios conlleva la aparición de
manifestaciones sistémicas inespecíficas que son la expresión de un
disbalance entre ambos grupos de mediadores (mortalidad media 7%). Es
diagnóstico de SRIS la presencia de dos o más de los siguientes:
-
Fiebre (temperatura superior
a 38º C) o hipotermia (temperatura
inferior a 36º C)
-
Frecuencia cardiaca superior
a 90
pulsaciones por minuto.
-
Frecuencia respiratoria
superior a 20
respiraciones por minuto o presencia de hipocapnia (pCO2 menor de 32 mm Hg)
-
Leucocitosis (más de 12.000/mm3)
o leucopenia (menos de 4.000/mm3) o más del 10% de formas inmaduras.
Esta misma presencia de criterios de SRIS supone un
estado de gravedad progresivo, a más criterios positivos más gravedad
y mayor mortalidad, entre el 3% de los pacientes sin criterios SRIS y el 17%
en los pacientes con los cuatro criterios positivos [15]. Además, la
respuesta positiva al tratamiento, con reducción de los criterios
presentes entre el primer día y el segundo parece ser un buen indicador
evolutivo, mientras que si el número de criterios se mantiene o se
incrementa, la mortalidad crece de modo exponencial [16].
A pesar de que el SRIS es un
marcador muy sensible de inflamación, aunque poco específico de patología
infecciosa (ya que puede ser desencadenado por multitud de factores), es
un buen indicador de gravedad del cuadro y de su repercusión orgánica, de
fácil realización a pie de cama y con aspectos evolutivos muy interesantes
que puede ayudarnos a identificar a aquellos pacientes con riesgo
incrementado al ingreso y al control posterior del paciente. Además la
mayor afectación orgánica se asocia a mayor riesgo infeccioso (en los
casos que su origen no sea séptico), con incremento de la posibilidad de
infección de 1,5 veces con dos criterios de SRIS hasta casi 5 veces cuando
se cumplen tres o cuatro criterios [17].
Sepsis: Corresponde a la reacción sistémica
inflamatoria debida a un foco claro infeccioso. Precisa para su
diagnóstico de dos o más criterios de SRIS y la presencia de cuadro
clínico evidente de infección o estudios microbiológicos (presencia de
microorganismos patógenos en líquidos habitualmente estériles, más de
100.000 UFC/ml en orina o en cultivos cuantitativos de secreciones
bronquiales); su mortalidad media es del 16%.
Sepsis grave: Sepsis que se acompaña de
alteraciones de la perfusión tisular, manifestándose como disfunción de
uno o varios órganos (mortalidad media 20%):
-
Hipotensión: presión
arterial sistólica menor de 90 mm Hg
-
Acidosis metabólica:
láctico mayor de 3 mmol/l
-
Oliguria: diuresis
menor de
30 ml/h durante 3 horas o 700 ml en 24 horas
-
Alteraciones
mentales agudas: agitación, obnubilación
-
Coagulopatía:
prolongación del tiempo de protrombina o plaquetopenia inferior a
100.000/ml
Shock séptico: Sepsis acompañada de hipotensión arterial e
hipoperfusión tisular sostenida a pesar de aporte de volumen suficiente o
necesidad de drogas vasopresoras para mantener tensiones arteriales
sistólicas adecuadas: mortalidad media 46%.
Esta primera aproximación a la
estratificación y pronóstico del paciente séptico debe ser complementada
con la evaluación de otros factores de gran relevancia, fundamentalmente
relacionados con las características específicas del paciente (edad y
comorbilidades), la repercusión sobre la función orgánica y el tipo de
infección causal, para lo cual deberemos recurrir a sistemas especialmente
desarrollados para ello.
La existencia de sistemas de evaluación de
la gravedad es prácticamente conocida por todos, siendo algunos de estos
sistemas aceptados a nivel mundial como herramientas de gestión y control
de calidad asistencial, y mecanismos de estratificación de los pacientes
para establecer rangos de gravedad, imprescindibles para un correcto
desarrollo de estudios multicéntricos.
Todos los sistemas generales de valoración y
estratificación de la gravedad de los pacientes críticos permiten
establecer estimaciones pronósticas. Estas son usadas de modo generalizado
para la realización de controles de calidad asistencial internos y entre
diferentes instituciones, mediante la comparación entre la mortalidad
predicha para el nivel de gravedad de los pacientes y la mortalidad real
(relación estandarizada de mortalidad).
APACHE (Acute Phisiology And Chronic Health
Evaluation), SAPS (Simplified Acute Physiology Score) y MPM (Mortality
Probability Model) son tres sistemas de puntuación de gravedad utilizados de forma
generalizada en las Unidades de Cuidados Intensivos (UCI). Pese a no ser
específicos para los pacientes sépticos, tienen una gran utilidad como
identificadores contrastados de los pacientes con gravedad incrementada y
por tanto con una estimación pronóstica conocida mediante cálculos
matemáticos validados.
Otros sistemas valoran fundamentalmente la
disfunción orgánica reactiva al insulto infeccioso, aplicando estimaciones
pronósticas en función de la gravedad y el número de órganos en fallo. De
ellos es especialmente conocido y aceptado el Sistema SOFA (Sepsis-related
Organ Faliure Assesment o Sequential Organ Faliure Assesment), por ser un
sistema de realización sencilla, tener un diseño específico para la sepsis
y un carácter evolutivo. Otros métodos de valoración de la disfunción
orgánica secundaria al insulto también difundidos, aunque menos utilizados
son LODS (Logistic Organ Dysfunction System) y MODS (Multiple Organ
Dysfunction Score).
APACHE (Acute Physiology and Chronic Health
Evaluation)
Fue descrito por Knaus et al en 1981 [18] como
un sistema capaz de clasificar a los pacientes ingresados en las unidades
de cuidados intensivos mediante la utilización de escalas fisiológicas que
se correlacionan con la gravedad de la enfermedad actual y la evaluación
del estado de salud previa del paciente. APACHE permite mediante cálculos
matemáticos establecer una probabilidad de muerte de los pacientes durante
su estancia en UCI y la mortalidad hospitalaria.
La afectación fisiológica (APS: Acute
Physiology Score) es valorada a través de ocho aparatos o sistemas: el
estado cardiovascular, la función respiratoria, la función renal, el
aparato gastrointestinal, el estado hematológico del paciente, la
respuesta séptica, el estado metabólico y la situación neurológica.
-
Cardiovascular: 7 variables (frecuencia cardiaca,
presión arterial media, presión venosa central, evidencia de infarto agudo
de miocardio, presencia de arritmias, lactato sérico y pH sanguíneo)
-
Respiratorio: 3 variables (frecuencia respiratoria
espontánea, P(A-a)O2 con FiO2 1 y paCO2).
-
Renal: 3 variables (diuresis diaria, BUN sérico y
creatinina sérica)
-
Gastrointestinal: 6 variables (bilirrubina, amilasa,
albúmina, fosfatasas alcalinas, GOT y anergia a pruebas de estimulación
cutánea)
-
Hematológico: 4 variables (hematocrito, plaquetas,
leucocitos y tiempo de protrombina).
-
Séptico: 4 variables (temperatura rectal, hemocultivos positivos, cultivos positivos para hongos y cultivos
positivos de LCR).
-
Metabólico: 6 variables (glucosa, calcio, sodio,
potasio, bicarbonato y osmolaridad plasmática)
-
Neurológico: 1 variable (Glasgow Coma Score)
Estas 34 variables son evaluadas durante las
primeras 32 horas tras el ingreso en UCI y puntuadas de 0 a 4 en función
de la desviación de los valores normales.
Además de las variables fisiológicas
descritas previamente, APACHE valora el estado de salud del paciente en
los 3-6 meses previos al ingreso, estratificándolo en cuatro grupos:
-
A: Buena salud previa sin limitación funcional
-
B: Leve a moderada limitación de la actividad, debida a problemas
de salud crónicos
-
C: Restricción seria pero no incapacitante de la actividad,
producida por problemas crónicos de salud
-
D: Restricción grave de la actividad por la enfermedad, incluyendo
a los pacientes encamados o ingresados en instituciones sanitarias
Tomadas ambas escalas, APACHE permite
establecer probabilidades pronósticas:
|
Puntos APACHE |
Mortalidad
hospitalaria
% |
|
0-5 |
2,3 % |
|
6-10 |
4,3 % |
|
11-15 |
8,6 % |
|
16-20 |
16,4 % |
|
21-25 |
28,6 % |
|
26-30 |
56,4 % |
|
>31 |
70 % |
Relación entre el estado de salud previo del
paciente y su resultado:
|
Estado de salud previo
al ingreso |
Probabilidad de muerte
en UCI |
Probabilidad de muerte
en el hospital |
|
A |
7,3% |
12% |
|
B |
5,9% |
12% |
|
C |
10,5% |
16,5% |
|
D |
11,7% |
25% |
Posteriormente este primer estratificador de
gravedad ha sufrido modificaciones tendentes a su simplificación y
perfeccionamiento. Así en 1985 Knaus et al [19] describieron el APACHE II,
que se desarrolló a partir de estudios realizados sobre 5.815 pacientes
ingresados en UCIs médicas y quirúrgicas de 13 hospitales.
En APACHE II se redujo sustancialmente el
número de variables fisiológicas y el tiempo mínimo necesario para su
valoración, se introdujo la edad como factor pronóstico, y se diferenció
entre pacientes médicos y quirúrgicos.
Los parámetros medidos en la escala de
afectación fisiológica aguda son menos que en APACHE, siendo seleccionados
los de mayor peso estadístico y puntuados igualmente de 0-4 en función de
la desviación de la normalidad:
La edad es igualmente puntuada en los
siguientes rangos:
|
≤ 44 años |
0 puntos |
|
45-54 años |
2 puntos |
|
55-64 años |
3 puntos |
|
65-74 años |
5 puntos |
|
> 75 años |
6 puntos |
El estado de salud previa diferencia tres
tipos de pacientes: pacientes no quirúrgicos, pacientes quirúrgicos
urgentes y pacientes quirúrgicos programados, valorando en cada uno de
ellos la presencia de fracasos orgánicos crónicos graves o estado de
inmunodepresión.
|
Tipo de paciente |
Estado de salud previo |
Puntos |
|
Paciente no quirúrgico |
Fracaso orgánico crónico o
inmunodepresión |
5 |
|
Sin fracaso e inmunocompetente |
0 |
|
Cirugía urgente |
Fracaso orgánico crónico o
inmunodepresión |
5 |
|
Sin fracaso e inmunocompetente |
0 |
|
Cirugía programada |
Fracaso orgánico crónico o
inmunodepresión |
2 |
|
Sin fracaso e inmunocompetente |
0 |
Con la suma de la puntuación de los tres
grupos de parámetros medidos [Apéndice I] podremos estratificar
aproximadamente el riesgo de fallecimiento del paciente en el hospital:
|
APACHE II y mortalidad
hospitalaria (%) |
|
Puntos |
0-4 |
5-9 |
10-14 |
15-19 |
20-24 |
25-29 |
30-34 |
> 35 |
|
P. méd. |
4 |
7 |
14 |
24 |
40 |
52 |
72 |
82 |
|
P. quir. |
2 |
4 |
7 |
12 |
30 |
36 |
72 |
88 |
La diferencia de mortalidad estimada
mediante APACHE II entre pacientes médicos y quirúrgicos es debida a que
la afectación orgánica aguda es menos grave en los pacientes postoperados
con baja puntuación, mientras que si la puntuación es alta, la
probabilidad de muerte se equipara en ambos grupos.
APACHE II es actualmente el sistema de
estratificación de gravedad más utilizado internacionalmente, y sirve como
patrón a la hora de realizar comparaciones entre distintos centros
sanitarios o entre diferentes países, lo que permite la realización de
estudios multicéntricos con las garantías suficientes de similitud en la
población estudiada. Sin embargo APACHE II no es un sistema predictor
perfecto, presentando errores de calibración importantes, fundamentalmente
derivados de que un parámetro fundamental como es la procedencia de los
ingresos no fue tenido en cuenta. Así, en estudios posteriores [20] se
comprobó la asociación independiente entre el origen del ingreso y la
mortalidad, siendo APACHE buen predictor en los pacientes ingresados
directamente desde urgencias pero infravalorador en los pacientes
ingresados desde planta convencional de hospitalización o que procedían de
otros hospitales.
APACHE III es la última revisión realizada
de esta escala de valoración de la gravedad [21-23], que perfecciona los
defectos detectados previamente, especialmente el origen de los ingresos e
incrementa las categorías de tipos de enfermedad. Las variables fisiológicas también han sido modificadas, al igual que la puntuación que
reciben en función de su peso predictivo. El desarrollo de los
coeficientes para el cálculo de la probabilidad de muerte no se encuentra
disponible en la literatura, siendo necesaria la adquisición de un sistema
de información clínica informático para su utilización, lo que ha limitado
de forma significativa su difusión y utilización a nivel internacional.
SAPS
(Simplified Acute Physiology Score)
Es una versión simplificada del apartado de afectación
fisiológica aguda de APACHE, desarrollado en 8 UCIs polivalentes de
Francia [24], que permite mediante la valoración de datos clínicos sencillos y
habituales en la clínica rutinaria de la UCI establecer un índice de
gravedad y una estimación pronóstica.
Al igual que APACHE II, SAPS requiere datos
de las primeras 24 horas de estancia en UCI, siendo estas variables las
siguientes:
- Edad
- Frecuencia cardiaca
- Presión arterial
sistólica
- Temperatura corporal
- Débito urinario
- Hematocrito
- Recuento
leucocitario
- Glucosa plasmática
- Urea plasmática
- Potasio plasmático
- Sodio plasmático
- Bicarbonato sérico
- Glasgow Coma Score
Sumando la puntuación de estas variables
puede obtenerse una estimación de mortalidad:
|
Puntos SAPS |
Mortalidad % |
|
5-6 |
10,7±4,1 |
|
7-8 |
13,3± 3,9 |
|
9-10 |
19,4± 7,8 |
|
11-12 |
24,5± 4,1 |
|
13-14 |
30,0± 5,5 |
|
15-16 |
32,1± 5,1 |
|
17-18 |
44,2± 7,6 |
|
19-20 |
50,0± 9,4 |
|
≥21 |
81,1± 5,4 |
Al igual que sucedió con APACHE, SAPS
también sufrió modificaciones para mejorar su rendimiento, incrementando
los parámetros valorados hasta 15 variables y con puntuaciones mas
ajustadas a su peso estadístico.
SAPS II [25-26] se validó mediante un gran
estudio internacional en el que se incluyeron 13.152 pacientes de 137 UCIs
europeas y norteamericanas. A las variables valoradas en SAPS se añaden
parámetros de disfunción hepática, renal y respiratoria, tipo de paciente
(médico, quirúrgico programado o quirúrgico urgente), presencia de SIDA,
neoplasias hematológicas o tumoraciones metastásicas [Apéndice II].
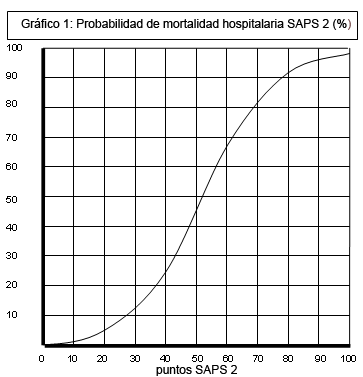
En el gráfico 1 puede comprobarse como la
previsión de mortalidad hospitalaria por SAPS II (%) sigue una curva de
incremento significativo de la mortalidad asociada al incremento en la
puntuación de SAPS II con una morfología sigmoidea, siendo únicamente los
valores bajos y los extremadamente altos poco expresivos de cambios
significativos en el % de mortalidad prevista.
MPM
(Mortality Probability Model)
Se desarrolló en un único hospital, con una muestra de 755 pacientes,
asignando valores a los parámetros con capacidad predictiva de mortalidad
hospitalaria mediante regresión logística [27]. Su modificación posterior
(MPM II) se basó en un estudio internacional con 12.610 pacientes y
fue validado en otra muestra posterior de 6.514 pacientes [28].
A diferencia de los indicadores previos, MPM
utiliza variables clínicas simples, obtenidas en el momento del ingreso
(MPM0) y a las 24 horas del mismo (MPM24), además de
la edad y el estado de salud previa.
Las variables utilizadas en MPM0
son:
Edad
Alteración fisiológica
aguda:
-
Coma o estupor
-
Frecuencia cardiaca
≥ 150 ppm.
-
Tensión arterial
sistólica ≤ 90 mmHg
-
Ventilación mecánica
-
Fracaso Renal Agudo
-
Arritmias cardiacas
graves
-
Accidente
cerebrovascular
-
Sangrado
gastrointestinal
-
Efecto masa craneal
-
Reanimación
cardiopulmonar previa al ingreso
Estado crónico de
salud:
Tipo de paciente:
MPM24 utiliza algunos de los
parámetros de ingreso y valora los cambios evolutivos en las primeras 24
horas de tratamiento en UCI. Las variables utilizadas son:
Edad
Parámetros evaluados
al ingreso:
Parámetros evaluados a
las 24 horas de tratamiento:
El MPM valora la presencia o no de las
variables descritas previamente y les asigna una puntuación en función de
su peso estadístico, lo que permite una estimación de la probabilidad de
supervivencia de forma directa.
La realización de MPM seriada de forma
diaria (MPM 24, MPM 48, MPM 72) permite
discernir si la evolución del paciente es adecuada a las medidas
terapéuticas aplicadas; así, un paciente que pese al tratamiento intensivo
mantenga coeficientes de MPM estables incrementa su probabilidad de muerte
de forma significativa [29].
Existen pocos estudios que hayan comparado
la rentabilidad de estos tres sistemas pronósticos generales, Lemeshow y
Le Gall [26] en una revisión de la literatura existente concluyen que
tanto APACHE III, SAPS II y MPM II tienen un desarrollo adecuado y una
capacidad pronóstica contrastada que justifica su utilización en UCI para
la estratificación del nivel de gravedad de la población atendida, su
probabilidad de muerte y con ello la posibilidad de establecer un control
de calidad asistencial interno y comparativo con otras unidades, y la
participación en estudios multicéntricos. Posteriormente Castella y col.
[30] desarrollaron un gran estudio multicéntrico con 14.745 pacientes en
el que compararon todos los sistemas de valoración de la gravedad APACHE
II-III, SAPS I-II y MPM I-II en el que se pudo comprobar como todas las
versiones más modernas superaban claramente a sus predecesoras en cuanto a
fiabilidad predictiva.
Con los sistemas actuales de APACHE, SAPS y
MPM es posible obtener una especificidad superior al 90% para predecir la
supervivencia, pero con una escasa sensibilidad para predecir la muerte,
lo que las hace insuficientes como para adoptar medidas limitantes de
ingreso o de esfuerzo terapéutico en casos individuales. Todos los
sistemas que utilizan variables obtenidas en las primeras 24 horas de
evolución del paciente en UCI únicamente dan información transversal de la
situación clínica inicial y no tienen en cuenta la posible respuesta
adecuada al tratamiento en días posteriores. De igual modo, los sistemas
evolutivos pueden influir de forma negativa en la actitud de lucha por el
paciente al obtenerse puntuaciones sugestivas de deterioro en la
probabilidad de supervivencia e inducir limitaciones asistenciales no
adecuadas.
|
5. Sistemas
de valoración de la gravedad en pacientes sépticos |
Los sistemas generales de valoración de la
gravedad en pacientes críticos desarrollados previamente (APACHE, MPM y
SAPS), aunque ampliamente aceptados y utilizados, no fueron pensados
específicamente para pacientes sépticos.
SOFA (Sepsis-related Organ Failure Assessment)
El Grupo de Trabajo de problemas relacionados con la
sepsis de la Sociedad Europea de Cuidados Intensivos, desarrolló una
escala específicamente diseñada para la valoración de la afectación multisistémica derivada de la agresión infecciosa [31], el sistema SOFA (Sepsis-related Organ Failure Assessment).
Este es un sistema sencillo, que utiliza
parámetros asequibles en la práctica clínica diaria para identificar la
disfunción o fracaso de los órganos fundamentales como consecuencia de la
sepsis. Fue desarrollado en una reunión de expertos y la valoración de las
alteraciones fisiológicas como respuesta a la agresión séptica fue
puntuada por consenso entre ellos. A pesar de esta subjetividad inicial,
la calibración de SOFA es correcta y se ajusta adecuadamente a la
evolución posterior del paciente como se demostró posteriormente en un
estudio internacional, multicéntrico, con 1.449 pacientes [32].
Los órganos o sistemas valorados por SOFA
son 6: aparato respiratorio, hemostasia, función hepática, sistema
cardiovascular, sistema nervioso central y función renal. Todos los
órganos son puntuados entre 0 y 4 en función de la variación respecto a la
normalidad, considerándose disfunción cuando los valores obtenidos
difieren escasamente de la normalidad (puntos 1-2), mientras que se
considera fracaso orgánico (puntos 3-4) cuando la variación de la
normalidad es significativa o se requieren medidas de soporte artificial
mecánico o farmacológico para su control. [Apéndice III].
A pesar de que SOFA fue diseñado como un
“descriptor” de la afectación evolutiva de la sepsis en el organismo,
actualmente es aplicado frecuentemente como “predictor” evolutivo y de
mortalidad. Así, la mortalidad observada es directamente proporcional a la
puntuación obtenida, desde un 8% con 2-3 puntos SOFA hasta prácticamente
el 100% si se superan los 12 puntos.
Muy interesante es la aplicación evolutiva
de SOFA (Sequential Organ Faliure Assessment), que permite hacer un
seguimiento de la afectación orgánica del paciente y valorar la respuesta
a las medidas terapéuticas aplicadas [32-33] al igual que se hacía con MPM.
En el estudio de Ferreira y col. [33] se comprueba como el incremento en la
puntuación SOFA de las primeras 48 horas, reflejo de mala respuesta al
tratamiento inicial, predice una mortalidad de al menos el 50%
independientemente de la puntuación inicial. Del mismo modo la puntuación
máxima en la escala SOFA, obtenida por un paciente durante su estancia en
UCI, es igualmente reflejo de un deterioro funcional multiorgánico
claramente relacionado con la mortalidad. Con puntuaciones máximas SOFA
durante la estancia en UCI superiores a 15 la mortalidad esperada es
superior al 90%, con una
sensibilidad del 30,7%, una especificidad del 98,9% y una correcta
clasificación del 84,2% [32].
MODS (Multiple Organ Dysfunction Score)
Es otra escala de valoración de la gravedad de los pacientes críticos
basada en la afectación orgánica derivada de la agresión [34].
Esta escala, que al igual que SOFA puede ser
realizada de forma progresiva durante la estancia del paciente en UCI,
permite una visión evolutiva de la enfermedad y su repercusión sobre la
fisiología en función de la respuesta al tratamiento y la capacidad de
recuperación funcional del paciente.
Los órganos y sistemas valorados por MODS
son la función respiratoria, función renal, función hepática, sistema
cardiovascular, hemostasia y estado neurológico [Apéndice IV], a los que
se les asigna una puntuación entre 0 y 4 en función de la desviación
respecto a la normalidad.
Con el sumatorio de los puntos obtenidos
puede calcularse la probabilidad de muerte del paciente como se desarrolla
en la tabla siguiente:
|
MODS: Disfunción orgánica múltiple y
mortalidad |
|
Puntuación |
Mortalidad (%) |
|
0 |
0 |
|
1-4 |
1 |
|
5-8 |
3 |
|
9-12 |
25 |
|
13-16 |
50 |
|
17-20 |
75 |
|
>20 |
100 |
*Datos derivados de Marshall JC y col. Crit
Care Med 1995; 23: 1638-1652
Ambos sistemas de valoración de la
disfunción orgánica SOFA y MODS fueron comparados por Peres Bota y col.
en 2002 [35] en un estudio observacional prospectivo con 949 pacientes, no
apreciándose diferencias significativas en la predicción de mortalidad de
ambas escalas. APACHE II presentó un valor predictivo similar a SOFA y
MODS en todos los pacientes.
SOFA presentó una mejor calibración que MODS
para la disfunción cardiovascular, tanto al ingreso como en los diferentes
periodos evolutivos del estudio (48 horas, 96 horas, puntuación máxima y
del último día en UCI), siendo el resto de órganos estudiados similares en
cuanto a calibración. Por tanto, los pacientes que presentan shock son
mejor calibrados con SOFA, dato de interés ya que es una situación clínica
frecuente en los pacientes críticos en general y probablemente más en los
pacientes sépticos.
IPS
(Infection Probability Score)
El uso de SOFA para la valoración de la
disfunción orgánica en pacientes sépticos fue la idea original de sus
diseñadores, pero dada su correcta calibración como predictor evolutivo de
gravedad y mortalidad ha sido incluido en escalas diseñadas para la
predicción del riesgo infeccioso, como complicación evolutiva, en
pacientes no sépticos. Así, Bota y col. [36] describieron una nueva
escala “Infection Probability Score” (IPS), destinada a estratificar a los
pacientes en función del riesgo infeccioso, con el objetivo de identificar
de modo precoz a aquellos con un riesgo incrementado. Esto permitiría la
adopción de las medidas necesarias para un diagnóstico precoz y no
demorar el inicio de un tratamiento antiinfeccioso, con consecuencias muy
negativas para el paciente. Del mismo modo, aquellos pacientes que
presenten un riesgo bajo infeccioso pueden beneficiarse de la no
realización de técnicas diagnósticas innecesarias (radiografías, cultivos
microbiológicos, etc.) añadiendo además una reducción de costes.
Esta escala de probabilidad de sepsis se
desarrolló a partir de un primer estudio prospectivo sobre 353 pacientes,
que fue validado posteriormente con 140 pacientes más. Las variables incluidas en la escala son:
temperatura corporal, frecuencia cardiaca, frecuencia respiratoria, cifra
de leucocitos, proteína C reactiva y puntuación SOFA.
|
Puntuación de probabilidad de
infección (puntos IPS) |
|
|
0 |
1 |
2 |
3 |
6 |
8 |
12 |
|
Tª
corporal ºC |
≤
37,5 |
|
>
37,5 |
|
|
|
|
|
FC
(ppm) |
≤ 80 |
|
|
|
|
81-140 |
> 140 |
|
FR
(rpm) |
≤ 25 |
> 25 |
|
|
|
|
|
|
Leucocitos (x103/mm3) |
5-12 |
> 12 |
|
< 5 |
|
|
|
|
PCR
(mg/dl) |
≤ 6 |
|
|
|
> 6 |
|
|
|
SOFA
score |
≤ 5 |
|
> 5 |
|
|
|
|
El punto de corte se estableció en 13 puntos
con un valor predictivo positivo de 72,2% y un valor predictivo negativo
del 95,9%. Es decir, un paciente con un IPS < 14 puntos tiene escasas
posibilidades de estar infectado.
De los parámetros analizados, la frecuencia
respiratoria se mostró como un valor con escaso valor predictivo ya que se
ve influenciada por múltiples factores en los pacientes críticos, y la
ventilación mecánica interfiere con frecuencia en su valoración.
Igualmente, la cifra de leucocitos es mal predictor, ya que la leucocitosis
puede ser debida a gran número de situaciones de stress, por el contrario
la leucopenia si mostró una mejor calibración en los pacientes sépticos.
En esencia, el IPS es una herramienta de
fácil realización, que no requiere determinaciones especiales y que
presenta fundamentalmente un buen valor predictivo negativo, lo que nos
permitirá evitar técnicas diagnósticas y tratamientos antibióticos
innecesarios con sus consecuencias económicas y microbiológicas.
-
Necesidad de unificar criterios diagnósticos y definir la
gravedad en función de parámetros clínico-biológicos consensuados.
-
Integrar la enfermedad infecciosa en el contexto del
paciente (predisposición, comorbilidades y respuesta a la agresión).
-
La gravedad de la disfunción orgánica, como respuesta a la
agresión infecciosa, es el principal marcador pronóstico (SRIS a sepsis, a sepsis grave, a shock séptico).
-
La evaluación de la gravedad de los pacientes críticos,
mediante escalas validadas, es imprescindible para establecer estudios
comparativos internos y entre poblaciones diferentes. Actualmente son
consideradas herramientas de gestión y control de calidad en UCI.
-
Los sistemas generales de evaluación de la gravedad internacionalmente más
difundidos son APACHE, SAPS y MPM.
-
APACHE, SAPS y MPM, en sus versiones más modernas presentan
una buena fiabilidad predictiva, claramente superior a sus versiones
predecesoras. Todos ellos permiten establecer una estimación pronóstica y
un cálculo de mortalidad teórica contrastados.
-
APACHE III es la escala de gravedad más completa, pero su
limitación fundamental estriba en que su desarrollo completo no se
encuentra disponible en la literatura.
-
SAPS y APACHE requieren un margen mínimo de tiempo de 24
horas para establecer una previsión pronóstica, mientras que MPM puede
establecerla desde el mismo momento del ingreso.
-
MPM tiene carácter evolutivo, pudiéndose realizar en
periodos progresivos de 24 horas. La estabilidad en la puntuación de MPM
pese al tratamiento supone un incremento en la probabilidad de muerte
significativo.
-
SOFA y MODS son los dos sistemas de evaluación de la
gravedad basados en la repercusión sobre la función orgánica de la
agresión, infecciosa o no infecciosa, más utilizados internacionalmente.
Ambos tienen una capacidad predictiva similar a APACHE II.
-
SOFA fue diseñado específicamente para pacientes sépticos
pero actualmente es utilizado de forma genérica para todos los pacientes
críticos.
-
MODS calibra peor la disfunción hemodinámica (respecto a
SOFA), lo que hace que esta escala tenga menos aplicación en pacientes
sépticos.
-
IPS es una escala interesante en la predicción de riesgo
infeccioso para pacientes críticos, basada en parámetros sencillos y
asequibles en la práctica clínica habitual.
-
Las escalas de valoración de la gravedad tienen una buena
capacidad predictiva de mortalidad/supervivencia global pero escasa
sensibilidad individual, por lo que hay que ser cauto en la interpretación
individualizada de un pronóstico.
-
Goldman L.
Quantitative aspects of clinical reasoningt. En Fauci AS,
Braunwald E, Isselbacher KJ y cols. Harrison’s
Principles of Internal Medicine. McGraw-Hill Inc, New York 1998; 9-14.
-
Berenson RA. Intensive Care Units: Clinical outcomes,
Cost and Decision making. Healt Tecnology Case Study 28, OTA-HCS 28,
U.S. Congress, Washington DC, 1984.
-
Cullen D, Keene R, Watenaux C et al. Severity of
illness, outcome analysis and cost of intensive care for critically ill
patients. En Parrillo JE, Ayres SM ed. Major Issues in Critical Care
Medicine. William & Wlikins, New York. 1984; 47-59.
-
Bone RC, Balk RA, Cerra FB et al. American College of
Chest Physicians/Society of Critical Care Medicine Consensus Conference:
Definitions for Sepsis and Organ Faliure and Guidelines for the use of
innovative therapies in sepsis. Chest 1992; 101: 1644-1655.
-
Abraham E,
Mathay MA, Dinarello CA, Vincet JL et al. Consensus
Conference definitions for sepsis, septic shock, acute lung injuru and
acute respiratory distress syndrome: Time for revaluation. Crit Care Med
2000; 28: 232-235.
-
Levy MM, Fink MP, Marshall JC, et al; 2001.
SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference.
Intensive Care Med 2003; 29: 530-538.
-
Vincent JL. Sepsis definitions. Lancet Infect
Dis 2002; 2: 135.
-
Mira JP, Cariou A, Grall F et al. Association of
TNF2, a TNF-alfa Promoter Poyimorfism, with septic shock susceptibility
and mortallity. JAMA 1999; 282: 561-568.
-
Vallés J,
Rello J, Ochagavia A et al. Community acquired
bloodstream infection in critically-ill adult patients. Impact of shock
and inappropriate antibiotic therapy on survival. Chest 2003;
123: 1615-1624.
-
Garnacho J,
García JL, Barrero AE et al. Impact on the outcome of
adequate empirical antibiotic therapy in patients admitted to the ICU by
sepsis. Crit Care Med 2003; 31: 2742-2751.
-
Alejandría MM, Lansang MA, Dans LF et al.
Intravenous immunoglobulin for treating sepsis and
septic shock (Cochrane Review). The Cochrane Library 2001; 2: 1-19.
-
Bernard GR, Vincent JL, Laterre P et al. Efficacy and
safety of recombinant human activated protein C for severe sepsis. N Eng
J Med 2001; 344: 699-709.
-
Marshall JC, Foster D, Mc Jenna E et al. Toronto
Hospital ICU Research Group: Quantification of the multiple organ
dysfunction syndrome (MODS) as a risk factor, outcome descriptor,
surrogate measure of morbidity in the ICU. Crit Care Med 1996; 24: A53.
-
Ferreira FL, Bota DP, Bross A et al. Serial
evaluation of the SOFA score to predict outcome in critically-ill
patients. JAMA 2001; 286: 1754-1758.
-
Rangel-Fausto MS, Pittet D, Costigan M et al. The
natural history of the Systemic Inflammatory Response Syndrome (SIRS).
JAMA 1995; 273: 117-123.
-
Barie PS, Hygo LJ. Epidemiology, risk factors, and
outcome of multiple organ disfunction syndrome in surgical patients. En
Bauer A, Faist E, Fry D. Multiple Organ Faliure. Springer 2000; 52-67.
-
Napolitano LM, Joshi M, McCarter RJ et al. Systemic
Inflammatory Response Syndrome Score at admission independently
predicts infection in blunt trauma patients. J Trauma 2001: 50: 817-820.
-
Knaus WA, Zimmerman JE et al. APACHE
–acute physiology and chronic healt evaluation: a physiologically
classification system. Crit Care Med 1981; 9: 591-597.
-
Knaus WA, Draper EA et al. APACHE II: A severity of
dissease classification system. Crit Care Med 1985; 13: 818-829.
-
Escarce JJ, Kelley MA. Admission source to the
medical intensive care unit predicts hospital death independent of
APACHE II score. JAMA 1990; 264: 2389-2394.
-
Knaus WA, Wagner DP et al. APACHE III prognostic
system: Risk prediction of hospital mortality fro critically ill
hospitalized adults.Chest 1991; 100: 1619-1636.
-
Lemeshow S, Le Gall JR, et al. Modeling the severity
of illness of ICU patients. JAMA 1994; 272: 1049-1055.
-
Wagner DP, Knaus WA, et mal.
Daily prognostic estimates for critically ill adults in intensive care
units: Results from a prospective multicenter inception cohort analisys.
Crit Care Med 1994: 22; 1359-1372.
-
Le Gall JR, Loira P et al. A simplified acute
physiology score for ICU patients. Crit Care Med 1984; 12: 975-977.
-
Le Gall JR, Lemeshow S, Saulnier F. A new simplified
acute physiology score (SAPS II) based on a European/North American
multicenter study. JAMA 1993; 270: 2957-2963.
-
Lemeshow S, Le Gall JR. Modeling the severity of
illness in ICU patients: A systems update. JAMA 1994; 272: 1049-1055.
-
Lemeshow S, Teres D, Pastides H et al. A method for
predicting survival and mortality of UCI patients using objetively
derived weights. Crit Care Med 1985; 13: 519-525.
-
Lemeshow S, Teres D, Klar J et al. Mortality
Probability Model (MPM II) based on an international cohort of intensive
care unit patients. JAMA 1993; 270: 2478-2486.
-
Lemeshow S, Klar J, Teres D, et al. Mortality
probability models for patients in the intensive care unit for 48 or 72
hours: A prospective, multicenter study. Crit Care Med 1994; 22:
1351-1358.
-
Castella X,
Artigas A, Bion J et al. A comparison of severity of
illness scoring systems for intensive care unit patients. Crit Care Med
1995; 23: 1327-1335.
-
Vincent JL, Moreno R et al. The SOFA (Sepsis-related
Organ Faliure Assessment) score to describe organ disfunction/faliure.
Intensive Care Med 1996; 22: 707-710.
-
Vincent JL, de Mendonca A, Cantraine F, Moreno R,
Takala J, Siter PM, Sprung CL, Colardyn F, Blecher s. Working Group on
“sepsis-related problems” of the European Society of Intensive Care
Medicine. Use of the SOFA score to assess the incidence of organ
dysfunction/failure in intensive care units: results of a multicenter,
prospective study. Crit Care Med 1998; 26: 1793-1800.
-
Ferreira FL, Bota DP, Brosss A, Melot C, Vincent JL.
Serial evaluation of the SOFA score to predict outcome in critically ill
patients. JAMA 2001; 286: 1754-1758.
-
Marsall JC, Coock DJ et al. Multiple Organ
Dysfunction Score : A reliable descriptor of a complex clinical outcome.
Crit Care Med 1995; 23: 1638-1652.
-
Peres Bota D, Melot C, Lopes Ferreira F, Nguyen Ba V,
Vincent JL. The Multiple Organ Dysfunction Score (MODS) versus the
Sequential Organ Failure Assessment (SOFA) score in outcome prediction.
Intensive Care Med 2002; 28: 1619-1624.
-
Bota D, Melot C, Ferreira F, Vincent JL. Infection
Probability Score (IPS): A method to help assess the probability of
infection in critically ill patients. Crit Care Med 2003; 31: 2579-2584.
Roberto Reig Valero
Hospital General de Castellón
©REMI,
http://remi.uninet.edu. Marzo 2005.
Palabras clave:
Sepsis, Escalas de gravedad, Pronóstico.
Busque en REMI con Google:
Envía tu comentario para su
publicación |