| |
|
 |
|
Proteína C activada
en la sepsis grave |
| |
|
[PDF 363 Kb, 17 pág] [Evaluación] [Curso en Internet de sepsis grave] |
| |
|
|
| El contenido de este
capítulo ha sido escrito sin que Lilly SA, patrocinador del curso,
haya participado en su elaboración o revisión ni haya dado ninguna
indicación sobre la misma. |
La sepsis grave es una entidad
clínicamente heterogénea y de fisiopatología compleja, cuyo tratamiento
requiere la aplicación de un conjunto de medidas que individualmente solo
podrían ofrecer una efectividad limitada, pero que llevadas a cabo de
manera sinérgica pueden producir un beneficio clínico mucho mayor
[1].
La campaña “sobrevivir a la
sepsis” (http://www.survivingsepsis.com/)
ha creado un marco concreto basado en la mejor evidencia disponible en la
actualidad [2], que promueve y facilita la
integración de las principales medidas terapéuticas para la sepsis grave
en un esquema de actuació dirigido a reducir su mortalidad (http://www.ihi.org/IHI/Topics/CriticalCare/Sepsis/).
El tratamiento de la sepsis grave
se dirige simultáneamente a tres objetivos, que se corresponden con los
estadios de la enfermedad: el tratamiento de la infección, el tratamiento
de la respuesta inflamatoria (sepsis), y el tratamiento de soporte de los
órganos disfuncionantes (sepsis grave).
La proteína C activada es el primer tratamiento de
eficacia probada en la sepsis
[3, 4]:
reduce la mortalidad en los pacientes con sepsis
grave de alto riesgo, y está indicada cuando existe disfunción de dos o
más órganos o una puntuación APACHE-II superior a 24 puntos en las 24
horas previas, en ausencia de contraindicaciones, y sumada a los mejores
estándares de tratamiento. El tratamiento con proteína C activada se debe
iniciar precozmente, en las primeras 24 horas de evolución de la sepsis
grave.
|
2. Alteraciones
de la hemostasia en la sepsis |
La sepsis
supone un potente estímulo inflamatorio y procoagulante, que, cuando no
puede ser compensado, conduce a la disfunción de órganos y la muerte
[5]. La interacción entre inflamación y coagulación
en la sepsis ha sido tratada en detalle en otro capítulo de este curso
[6], y en varias revisiones recientes [7-10].
En la sepsis
grave se producen importantes alteraciones en el sistema hemostático:
activación de la coagulación, y disminución de la actividad anticoagulante
y fibrinolítica. La coagulación se inicia por la expresión endotelial de
factor tisular, inducida por mediadores inflamatorios, y se asocia a
consumo de los inhibidores naturales de la coagulación antitrombina III,
proteína C y proteína S. Como resultado de esta activación, se encuentran
en plasma niveles elevados de complejo trombina-antitrombina (TAT). Los
efectos sobre la fibrinolisis se ven dominados por niveles aumentados de
inhibidor del activador del plasminógeno tipo I (PAI-1), que resulta en
una fibrinolisis inadecuada. Aunque los niveles de activador del
plasminógeno se encuentran aumentados, su actividad se ve inhibida por el
PAI-1. El efecto neto es un estado procoagulante, con depósitos
diseminados de fibrina en la microvasculatura, que puede contribuir al
desarrollo de disfunción orgánica múltiple [11].
Existen tres
vías naturales que contrarrestan la diátesis trombótica: el inhibidor de
la vía del factor tisular, la antitrombina y la proteína C. El espectro de
acción de dichas moléculas no se limita al sistema de la coagulación, sino
que también ejercen una actividad antiinflamatoria, modulando la
producción de citoquinas y la interacción entre los leucocitos y el
endotelio vascular. Las tres sustancias han sido evaluadas mediante
ensayos clínicos en la sepsis, pero solo la proteína C activada ha
demostrado eficacia clínica [12].
La proteína C es una molécula de
elevado peso molecular (55 kDa),
vitamina K dependiente, sintetizada en el hígado como zimógeno (forma
inactiva). Se convierte en proteína C activada (PCA) por el complejo
trombina-tronbomodulina (figura 1), proceso que se potencia por el
receptor endotelial de la proteína C. La PCA es un potente inhibidor de la
generación de trombina, al inactivar de forma irreversible los factores Va
y VIIIa en el endotelio vascular; esta inactivación provoca una
prolongación en el tiempo parcial de tromboplastina activada (aPTT). El
efecto anticoagulante de la PCA requiere la presencia de un cofactor, la
proteína S, que se sintetiza en el hígado en forma activa. La PCA tiene
también efecto profibrinolítico, al inhibir el inhibidor de la
fibrinolisis PAI-1. Finalmente, la PCA posee efectos antiinflamatorios,
reduciendo la producción de citoquinas y la apoptosis celular.
Los niveles de PCA se encuentran
disminuidos en déficit de vitamina K, insuficiencia hepática, coagulación
intravascular diseminada (CID) y sepsis grave. En la sepsis grave, la
reducción de los niveles de PCA es casi constante, y se debe a varios
factores: disminución de la síntesis hepática de proteína C, disminución
de su activación endotelial, reducción de la biodisponibilidad de la PCA
por la activación del complemento, inhibición de la PCA por el PAI-1 y
consumo de la PCA en el proceso de la CID. El descenso de los niveles de
PCA es precoz en la sepsis, es un marcador de gravedad y tiene valor
pronóstico.
La PCA humana recombinante [PCAhr]
(drotrecogina-alfa activada) actúa de una manera análoga a la PCA nativa:
inhibe la coagulación, reduce la inflamación y aumenta la fibrinolisis
[13]. Su farmacocinética difiere poco de la natural
[14]. En el
estudio en fase 2 para búsqueda de dosis
[15], se
concluyó que la dosis óptima de PCAhr para el tratamiento de adultos con
sepsis grave era de 24 mcg/kg/hora en infusión intravenosa continua
durante 96 horas. La infusión de PCAhr produce un descenso
dosis-dependiente de los niveles de dímero D, como consecuencia del efecto
anticoagulante del fármaco; sin embargo, finalizado el periodo de infusión
de 96 horas se observa una elevación de rebote en los niveles de dímero D,
lo que indica que ese periodo de tratamiento puede suponer en algunos
casos una resolución incompleta del estado procoagulante inducido por la
sepsis, y abogaría por la prolongación del tratamiento más allá de las 96
horas, hasta la consecución de una mayor resolución del episodio de sepsis
como medio para mejorar la disfunción de órganos.
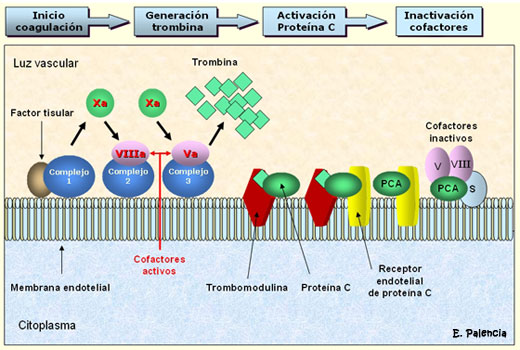
Figura 1. Activación endotelial de la proteína C e inactivación de
factores de coagulación.
Una historia de cambio de parejas: la proteína C tiene interés por el
receptor, y la trombina y la trombomodulina se lo presentan. Una vez que
entra en contacto con él queda activada; la proteína C activada se une con
la proteína S, y juntas se emparejan con los factores activados Va y VIIIa,
dejándolos fuera de juego.
En pacientes con sepsis grave, el
tratamiento con PCAhr induce un aumento del aPTT de unos 7 seg. de mediana
el primer día, prolongación que se reduce en los siguientes días de
tratamiento, probablemente como consecuencia de la mejoría de la CID. En
el estudio fase 2 que evaluó distintas dosis y duraciones de la infusión
15, se observó que a la dosis de 24 mcg/kg/hora el 8,3% de los
pacientes presentaban un aPTT superior a 95 seg, lo que indica la
conveniencia de medir este parámetro durante el tratamiento, en especial
durante las primeras 24 horas. La prolongación del aPTT puede variar
durante el tratamiento, por lo que mientras dura el mismo el estado de la
coagulopatía del paciente no puede ser evaluado. No obstante, a las dos
horas de interrumpir la infusión cualquier efecto del tratamiento con
PCAhr sobre las pruebas de laboratorio de hemostasia desaparecen, y éstas
reflejan la coagulopatía subyacente.
El efecto de la PCAhr sobre el
tiempo de protrombina (TP) es menor que sobre el aPTT, típicamente se
prolonga menos de 3 seg., por lo que el TP (y el INR) son por regla
general indicadores válidos del estado de coagulopatía del paciente
durante el tratamiento con PCAhr.
La PCAhr no tiene efecto sobre el
recuento de plaquetas de los pacientes, y la mejora del estado de CID que
produce el tratamiento no modifica este parámetro. La trombopenia grave se
ha identificado como el principal factor de riesgo intrínseco de
complicaciones hemorrágicas durante el tratamiento con PCAhr, por lo que
la trombopenia grave debe ser tratada con transfusión de plaquetas, para
mantener una cifra superior a 30.000. Hay que señalar que los pacientes
con trombopenia y/o CID se benefician del tratamiento con PCAhr de manera
similar o incluso mayor que el resto de los pacientes con sepsis grave.
Mientras que la trombopenia extrema (cifras inferiores a 30.000 plaquetas/mcL)
se considera una contraindicación al uso de PCAhr, la trombopenia inferior
a 100.000 es un criterio de disfunción de órganos, circunstancia que
predice el beneficio terapéutico con este fármaco.
La IL-6 es una citoquina
proinflamatoria, cuyos niveles se encuentran aumentados en la sepsis
grave, y el riesgo de muerte aumenta con el aumento de los niveles de
IL-6. La PCAhr disminuye los niveles de IL-6, lo que refleja la actividad
antiinflamatoria del fármaco.
La PCAhr tiene una vida media alfa
de 13 minutos, y una vida media beta de 1,6 horas. La concentración de
equilibrio se consigue rápidamente después del inicio de la infusión,
alcanzándose el 75% en 40 minutos y el 90% en 1,8 horas, por lo que no se
requiere la administración de bolo inicial. En voluntarios sanos, la dosis
de 24 mcg/kg/hora produce una concentración plasmática (en estado de
equilibrio) de 72 mcg/L, y en pacientes con sepsis grave de 45 mcg/L. El
volumen de distribución en equilibrio de la PCA es pequeño (17,6 L),
similar al del espacio extracelular, lo que se atribuye a su elevado peso
molecular, que le impide atravesar membranas. El aclaramiento plasmático
en voluntarios sanos es de 26 L/h, mientras que en la sepsis grave es de
40 L/h; este mayor aclaramiento explica la menor concentración en estado
de equilibrio vista en la sepsis grave comparada con los voluntarios
sanos. El aclaramiento plasmático de la PCAhr no se modifica con la dosis
ni con la duración de la infusión.
La PCAhr se inhibe por acción de
varias proteasas séricas, de las que la más importante es el inhibidor de
la proteína C (PCI), lo que resulta en una vida media de eliminación
corta, de 13 minutos. A los 40 minutos, 1,8 horas y 4,5 horas de suspender
la infusión se eliminan aproximadamente el 75%, 90% y 97% del fármaco,
respectivamente, de manera que a las dos horas de suspendida la infusión
no queda ningún efecto farmacológico de la PCAhr. El aclaramiento aumenta
con el peso corporal, por lo que la dosis se debe ajustar al peso, pero no
se ve influido por edad, sexo, presencia de comorbilidades, gravedad o
coadministración de heparina. En pacientes con sepsis grave y disfunción
hepática o renal el aclaramiento está solo ligeramente disminuido, y se
mantiene siempre dentro del rango intercuartil, no precisándose ajuste de
dosis. El grado de coagulopatía o los niveles de marcadores inflamatorios
(IL-6) tampoco influyen en el aclaramiento. Los estudios farmacocinéticos
llevados a cabo con PCAhr no difieren de manera significativa entre
sujetos sanos y pacientes con enfermedad renal terminal que reciben
hemodiálisis.
El estudio PROWESS (“PROtein C
Worldwide Evaluation in Severe Sepsis”) 3 fue un ensayo clínico
multicéntrico, aleatorizado, doble ciego, controlado con placebo, que
incluyó 1.690 pacientes con sepsis grave de menos de 24 horas de
evolución, que fueron tratados durante 96 horas con una perfusión de 24
mcg/kg/hora de PCAhr (PCA) o placebo. La puntuación APACHE-II mediana de
los pacientes fue de 25 puntos; el 70% de los pacientes estaban en shock y
el 75% recibieron ventilación mecánica. Casi todos los pacientes tenían
niveles bajos de PCA nativa y niveles elevados de dímero D e interleuquina-6,
que se normalizaron con el tratamiento. La tabla I recoge los principales
criterios de inclusión y exclusión.
|
Tabla I: Criterios
de inclusión y exclusión en el estudio PROWESS |
|
|
Criterios de
inclusión:
- Infección sospechada o probada
- Síndrome de respuesta inflamatoria sistémica
(tres criterios)
- Disfunción de uno o más órganos inducidos por
la sepsis en las 24 horas previas
Criterios generales de exclusión:
- Obesidad mórbida (más de 135 kg)
- Pacientes moribundos o con limitación del
esfuerzo terapéutico
- Pancreatitis
- Insuficiencia renal crónica
-
Hepatopatía crónica grave (hipertensión portal, hiperbilirrubinemia
crónica)
- Hipersensibilidad conocida al fármaco
Criterios de exclusión por riesgo aumentado de hemorragia:
- Hemorragia interna activa
- Patología
intracraneal, neoplasia o herniación cerebral
- Uso
simultáneo de heparina a dosis anticoagulantes (≥ 15 UI/kg/hora)
- Diátesis
hemorrágica conocida excepto la coagulopatía aguda asociada a la
sepsis
-
Trombopenia inferior a 30.000/mm3, incluso si el recuento se aumenta
con transfusión de plaquetas
- Pacientes
con riesgo alto de hemorragia, por ejemplo: cirugía mayor o
anestesia raquídea en las 12 horas previas, catéter epidural,
cirugía prevista durante el periodo de infusión, historia en los tres meses previos de TCE
grave, hemorragia cerebral o cirugía del SNC, historia de aneurisma
o malformación vascular del SNC, diátesis hemorrágicas congénitas,
hemorragia digestiva en las seis semanas previas (salvo que se haya
realizado corrección quirúrgica definitiva de la lesión causante),
pacientes traumatizados con riesgo de hemorragia aumentado
- Tratamiento con medicamentos que aumentan el
riesgo de hemorragia: heparina no fraccionada o de bajo peso
molecular a dosis mayores que profilácticas, anticoagulantes orales
en los 7 días previos o con prolongación del tiempo de protrombina,
aspirina en dosis de más de 650 mg/día en los tres últimos días,
fibrinolíticos administrados en los tres últimos días,
administración de inhibidores de la glicoproteína IIb-IIIa en los
siete días previos, administración de más de 10.000 U de
antitrombina en las 12 horas previas, administración de concentrado
de proteína C en las 12 horas previas.
Criterios de
exclusión por estado hipercoagulable:
- Resistencia conocida a la PCA (mutación Leyden)
- Déficit hereditario conocido de proteína C,
proteína S o antitrombina
- Presencia de anticuerpos anticardiolipina,
anticoagulante lúpico o homocisteinemia
- Episodio reciente de trombosis venosa profunda
o embolia pulmonar
|
|
|
4.1. Mortalidad
El tratamiento con PCA se asoció a una reducción
estadísticamente significativa (p = 0,005) de la mortalidad por cualquier
causa a los 28 días, desenlace principal del estudio. La mortalidad de los
pacientes tratados con PCA fue del 24,7%, frente al 30,8% del grupo
placebo, lo que supone una reducción del riesgo relativo del 19,4% (IC
95%: 6,6%-30,5%), una reducción del riesgo absoluto del 6,1%, y un número
necesario de tratamientos para salvar una vida (NNT) de 16.
Se realizó análisis de subgrupos definidos
prospectivamente con respecto a comorbilidades, gravedad (puntuación
APACHE-II, número de órganos disfuncionantes), edad, sexo, foco de
infección, tipo de microorganismo, presencia o ausencia de déficit de
proteína C, trombopenia o CID, sin encontrarse heterogeneidad entre ellos
con respecto al efecto sobre la mortalidad. Un análisis detallado de
subgrupos [16] puso sin embargo de manifiesto que el beneficio sobre la
mortalidad se concentraba en los subgrupos de mayor riesgo de muerte
(puntuación APACHE-II por encima del percentil 50, con puntuaciones
superiores a 24 puntos, o disfunción de dos o más órganos, o mortalidad
esperada superior al 30%). El tratamiento fue aprobado en Estados Unidos
por la FDA para pacientes con puntuación APACHE-II superior a 24 puntos en
las 24 horas previas, y en Europa por la EMEA, con un criterio menos
restrictivo y más práctico, para pacientes con disfunción de dos o más
órganos (tabla II).
|
Tabla II: Eficacia
de la PCA y riesgo de muerte (estudio PROWESS) |
|
|
|
Mortalidad por cualquier causa a los 28
días |
PCA |
Placebo |
RRA |
RRR |
NNT |
|
|
|
Todos los casos (n=1.690) |
24,7% |
30,8% |
19,4% |
6,1% |
16 |
|
Disfunción ≥ 2 órganos (75% de los casos) |
26,5% |
33,9% |
22% |
7,4% |
14 |
|
APACHE-II > 24 puntos (50% de los casos) |
30,9% |
43,7% |
29,3% |
12,8% |
8 |
|
RRR: Reducción de riesgo relativa; RRA: Reducción de riesgo absoluta;
NNT: Número necesario de pacientes tratados con PCA para salvar
una vida |
La campaña sobrevivir a la
sepsis, en las recomendaciones para el tratamiento de la sepsis grave y el
shock séptico, extienden la indicación a los casos de riesgo elevado de
muerte identificados por dos criterios clínicos sencillos: presencia de
shock séptico, o síndrome de distrés respiratorio agudo inducido por la
sepsis [2].
4.2 Disfunción de
órganos
Los
pacientes tratados con PCA presentaron una mejoría en la función de
órganos comparados con el grupo placebo, con puntuaciones SOFA
cardiovasculares más bajas, una resolución más rápida de la disfunción
cardiovascular y respiratoria y un comienzo más lento de la disfunción
hematológica [17].
4.3 Riesgo de
hemorragia
En el
estudio PROWESS la incidencia de episodios adversos graves fue similar en
los grupos que recibieron PCA y placebo, tanto durante las 96 horas de
infusión (6,8% y 6,5%) como durante los 28 días del seguimiento (12,5% y
12,1%). La mayor frecuencia de complicaciones hemorrágicas con PCA se vio
compensada con una mayor número de complicaciones trombóticas en el grupo
placebo.
El
único efecto secundario significativo que se ha objetivado con el uso de
la PCA es la hemorragia, complicación predecible en un fármaco
anticoagulante y fibrinolítico. En el estudio PROWESS se produjeron
hemorragias graves en el 2,4% de los pacientes durante el periodo de
cuatro días que duró la infusión, frente al 1% con placebo (p = 0,024);
después del periodo de infusión el riesgo de hemorragia fue similar con
PCA y con placebo, resultando una diferencia no significativa en la
incidencia acumulada de hemorragia grave durante los 28 días de
seguimiento (3,5% frente a 2%; p= 0,06). El exceso de hemorragias graves
en los pacientes tratados con PCA estuvo relacionado con la práctica de
procedimientos invasivos, mientras que las hemorragias no relacionadas con
procedimientos invasivos fueron similares en los dos grupos.
Posteriormente se analizó la experiencia acumulada sobre la seguridad de
la PCA en 2.786 pacientes adultos con sepsis grave participantes en los
ensayos clínicos fase 2 y 3, y en 3.991 pacientes adicionales que
recibieron el fármaco en uso comercial, procedentes de una base de datos
de farmacovigilancia [18].
El porcentaje de casos que presentaron hemorragia grave durante el periodo
de infusión fue del 2,8%, y durante los 28 días del seguimiento, un 2,5%
adicional. La mitad de las hemorragias graves ocurridas durante el periodo
de infusión se relacionaron con la práctica de procedimientos invasivos.
Se produjeron hemorragias mortales en el 0,4% de los casos (1 de cada 250
tratamientos). Se produjo hemorragia cerebral en el 0,6% de los casos
durante el periodo de infusión, y en un 0,5% adicional durante el periodo
de seguimiento de 28 días. En las dos terceras partes de los casos (62,5%)
las hemorragias cerebrales se produjeron en pacientes con trombopenia
inferior a 30.000 y/o meningitis, que se han identificado como los dos
principales factores de riesgo de esta complicación. Entre los 3.991
pacientes registrados que recibieron la PCA en uso comercial, se
produjeron hemorragias graves en el 0,9%, y hemorragias cerebrales en el
0,2% de los casos. Los episodios hemorrágicos graves se presentan más a
menudo durante el primer día de tratamiento, y disminuyen rápidamente en
los días siguientes.
4.4 Eficacia y seguridad en
los pacientes con disfunción de dos o más órganos
En los pacientes con disfunción
de dos o más órganos [19], que constituyeron
el 75,2% de los pacientes reclutados en el estudio PROWESS, y que
corresponden a la indicación de PCA aprobada en Europa, el tratamiento
redujo la mortalidad a los 28 días comparado con placebo (26,5% frente a
33,9%; RRA 7,4%; RRR 22% [IC 95%: 8-34%]; NNT 14).
La reducción del riesgo de muerte aumentó con el número de órganos
disfuncionantes, siendo del 1,7% con disfunción de 1 órgano, 5,3% con dos,
8,2% con tres y 10,6% con cuatro o más órganos. No se observaron
diferencias en la eficacia del tratamiento en los distintos subgrupos
analizados (foco de infección, tipo de microorganismo, órganos
disfuncionantes, edad, sexo, etc.), salvo la gravedad previa al inicio de
la infusión, medida mediante la puntuación APACHE-II. El tiempo hasta la
resolución de la disfunción de órganos fue más corto en los tratados con
PCA que en el grupo placebo para las disfunciones cardiovascular y
respiratoria: a los 7 días la disfunción cardiovascular se había resuelto
en el 61,2% de los tratados con PCA frente al 54,2% de los tratados con
placebo, y el 16,7% de la disfunción respiratoria comparado con el 11,3%
con placebo. Para las disfunciones renal, hepática y hematológica no se
encontraron diferencias significativas. Hubo un 3,8% de hemorragias graves
con PCA y un 2,4% con placebo.
4.5 Efecto a largo plazo
La reducción de la mortalidad a los 28 días de los
pacientes tratados con PCA en el ensayo PROWESS se prolongó hasta el alta
hospitalaria (29,7% con PCA frente a 34,9% con placebo; p = 0,03), pero
solo se mantuvo en el tiempo en los pacientes de alto riesgo de muerte,
identificados por la puntuación APACHE-II [20].
Los pacientes con APACHE-II > 24 tuvieron una supervivencia mediana de 450
días frente a 71 días con placebo (p = 0,0005), lo que se traduce en que
por cada 100 pacientes tratados se consiguen 75 años adicionales de vida.
La supervivencia a los 3 meses fue 58,9% frente a 48,4%; la supervivencia
a los seis meses fue 55,2% frente a 45,3%, al año fue 52,1% frente a
41,3%, y a los dos años y medio aún se mantenía una diferencia sustancial
a favor de la PCA: 45,6% frente a 33,8% (p = 0,001). Entre los pacientes
con APACHE-II < 25, la diferencia de supervivencia solo alcanzó
significación estadística al año, pero no en los otros intervalos de
tiempo preespecificados.
El aumento de la
supervivencia conseguido con PCA no aumentó las estancias en UCI y en el
hospital ni el consumo de recursos [21]. La estancia mediana en UCI fue de
9 días en ambos grupos, y la estancia hospitalaria fue de 16 y 17 días
respectivamente para los grupos placebo y PCA (p = 0,22). No se
encontraron diferencias entre las puntuaciones TISS (cargas de enfermería)
entre los grupos PCA y placebo ni entre los distintos subgrupos de
gravedad. Las dos terceras partes de los supervivientes de cada grupo
fueron dados de alta a su domicilio.
4.6 Neumonía adquirida en la
comunidad
La neumonía adquirida en la comunidad (NAC)
[22] constituye el subgrupo más grande del ensayo
PROWESS en lo que al foco de infección se refiere (35,6% de todos
los pacientes incluidos en el estudio); el 26,1% de los episodios de CAP
tenían infección documentada por Streptococcus pneumoniae, y en el
40% de los casos no se identificó el microorganismo causal. La mayoría de
los pacientes fueron incluidos el segundo día de su estancia en el
hospital, y el 59% precisaron soporte vasopresor. Entre los pacientes con
sepsis grave causada por NAC, el tratamiento con PCA se asoció a una
reducción del riesgo relativo de muerte a los 28 días del 28%, que a los
90 días era del 14%. El beneficio del tratamiento fue mayor en los
pacientes con NAC producida por S. pneumoniae, y en los pacientes
con mayor gravedad, medida por el APACHE-II y por distintos sistemas de
puntuación de gravedad específicos para la NAC (PSI, CURB-65).
|
5. Situaciones
especiales |
5.1 Insuficiencia renal aguda
y crónica
Los
pacientes con insuficiencia renal crónica terminal fueron excluidos del
estudio PROWESS por requerir anticoagulación con heparina durante la
hemodiálisis y por disponerse de escasa información previa sobre la vida
media de la PCA en esta situación. Los pacientes incluidos en el estudio
que desarrollaron insuficiencia renal aguda recibieron hemofiltración o
hemodiálisis, pero no se permitieron dosis de heparina superiores a 15.000
U/día, sin que se encontrara en ellos una mayor incidencia de episodios
hemorrágicos.
Debido a
su elevado peso molecular, la PCA no se elimina por hemofiltración o
hemodiálisis. Los estudios farmacocinéticos y farmacodinámicos realizados
en el estudio PROWESS mostraron que la concentración plasmática y vida
media de la PCA no difiere entre los pacientes con insuficiencia renal
aguda con o sin diálisis y el resto de los pacientes. Basándose en estos
datos, los pacientes con insuficiencia renal terminal y hemodiálisis
periódica no deben excluirse de tratamiento con PCA si está indicado,
aunque por no existir experiencia previa, dichos pacientes deben ser
objeto de farmacovigilancia.
La
depuración extrarrenal continua en los pacientes con sepsis grave tratados
con PCA puede llevarse a cabo sin añadir heparina u otros anticoagulantes
en el circuito en los casos que presentan prolongación basal de los
tiempos de coagulación y disminución del recuento de plaquetas. Si se
produce la coagulación del circuito, se puede añadir heparina de la manera
habitual, con control del aPTT.
5.2 Tratamiento concomitante
con heparina
La PCA
nativa se inhibe fisiológicamente por varias sustancias, de las que tiene
el efecto más potente el inhibidor de la proteína C (PCI), que inhibe la
formación del complejo trombina-trombomodulina, lo que impide la
activación de la proteína C. La heparina acelera la inhibición de la PCA
por el PCI más de 1.000 veces, efecto que comparten las heparinas de bajo
peso molecular, por lo que existe la posibilidad de una interacción
farmacológica entre ambas sustancias, heparinas y PCA.
En el
estudio PROWESS se permitió el uso abierto y no aleatorizado de heparina
no fraccionada a dosis no superiores a 15.000 U/día o heparina de bajo
peso molecular a dosis antitrombóticas pero no anticoagulantes. El 75% de
los pacientes recibieron algún tratamiento con heparina durante la
infusión de PCA, sin que se encontrara un mayor riesgo de complicaciones
hemorrágicas con respecto a los que no la recibieron. Se observó una
interacción entre ambos tratamientos, heparina y PCA: los enfermos que
fueron tratados concomitantemente con heparina tuvieron una menor
reducción relativa de la mortalidad a los 28 días. Esto se debió a que los
pacientes que recibieron placebo y heparina tuvieron una menor mortalidad
que los que recibieron placebo sin heparina (tabla III). Sin embargo, los
datos son una observación a posteriori que se encuentra muy
probablemente sesgada por el hecho de que el tratamiento con heparina no
fue aleatorizado sino que se dejó a criterio del médico, y los pacientes
que recibieron heparina pueden haber presentado menor gravedad o menor
riesgo de complicaciones hemorrágicas, por lo que no debe interpretarse
que la heparina disminuya la efectividad de la PCA ni, al contrario, que
la heparina sea un tratamiento eficaz para la sepsis grave.
|
Tabla III: Eficacia
de la PCA en pacientes con y sin heparina (PROWESS) |
|
|
|
Mortalidad por cualquier causa
a los 28 días |
PCA |
Placebo |
|
|
|
Todos los pacientes |
24,7% |
30,8% |
|
Pacientes tratados con heparina |
24,9% |
28,1% |
|
Pacientes tratados sin heparina |
24,1% |
39,4% |
|
|
5.3 PCA en pacientes con
alteraciones de la hemostasia
Los
pacientes con sepsis grave presentan un estado de CID que se manifiesta
por una activación de la coagulación (elevación de los niveles de
complejos trombina-antitrombina), formación acelerada de trombina (niveles
elevados de fragmentos F1 + 2) y reducción de la fibrinolisis (niveles
elevados de PAI-1). El 99,7% de los pacientes del estudio PROWESS tenían
niveles elevados de dímero D. Empleando los criterios de definición de CID
más restrictivos propuestos por la Sociedad Internacional de Trombosis y
Hemostasia [23], el 19% de los pacientes del PROWESS tenían CID, y en
estos casos la reducción de la mortalidad fue mayor que en el resto de
pacientes, con una disminución del riesgo absoluto de muerte del 14,2%
comparado con el placebo 16. Los pacientes con CID, por tanto,
deben recibir tratamiento con PCA, si está indicado (disfunción de dos o
más órganos o APACHE-II > 24), y si no presentan contraindicaciones
(hemorragia activa, menos de 30.000 plaquetas), aun cuando presenten
prolongaciones de los tiempos de coagulación (TP, aPTT) y/o trombopenia no
extrema.
La PCA tiene un coste medio
aproximado (para un tratamiento completo de 96 horas) de algo más de 7.000
€, en función del peso corporal que se emplea para ajustar su
dosificación, y ha sido considerado coste-efectivo cuando se utiliza con
las indicaciones aprobadas por la FDA y la EMEA. En España [24] se ha
estimado un coste medio de 9.800 € por año de vida ganado en pacientes con
sepsis grave y disfunción de dos o más órganos, lo que ha sido comparado
favorablemente con otras medidas preventivas o terapéuticas aceptadas y de
uso habitual. En otros países de Europa, la PCA se ha encontrado
coste-efectiva teniendo en cuenta la calidad de vida en la sepsis grave
con disfunción de dos o más órganos, mejorando la relación
coste-efectividad con el número de órganos disfuncionantes [25, 26].
En Estados Unidos y Canadá se ha
encontrado también una favorable relación coste-efectividad bruta y
ajustada por la calidad de vida, para pacientes con puntuaciones APACHE-II
superiores a 24 puntos [27, 28]. El coste por año de vida ganado aumenta
con la edad, y la
PCA es
coste-efectiva en los pacientes más graves que tienen una expectativa de
vida razonable tras sobrevivir al episodio de sepsis.
|
7. ENHANCE:
precocidad de la administración |
Con
posterioridad al PROWESS se ha llevado a cabo el ENHANCE, estudio abierto
no controlado con criterios de inclusión muy similares al PROWESS, cuyo
objetivo era confirmar sus resultados y aumentar la experiencia con esta
terapia. En el ENHANCE, la mortalidad a los 28 días fue del 25,3%, muy
similar a la del grupo tratado con PCA en el PROWESS (24,7%); si se tienen
en cuenta solo los datos de los países que participaron en el PROWESS, la
mortalidad del tratamiento con PCA en el ENHANCE es del 23,4%. Este
estudio no ha sido publicado aún de forma completa, pero sus resultados
principales confirman la eficacia y seguridad globales del tratamiento con
PCA en la sepsis grave.
Los datos
publicados en forma de resumen del estudio ENHANCE (cuyas referencias no
se incluyen aquí) muestran que el tratamiento precoz con PCA (en las
primeras 24 horas) se asocia a una disminución de la mortalidad
hospitalaria, un acortamiento de la estancia en UCI y en el hospital, un
menor consumo de recursos (menor duración de la ventilación mecánica y de
uso de fármacos vasoactivos), y una disminución de los costes
hospitalarios entre los supervivientes, comparados con el mismo
tratamiento iniciado más tardíamente, lo que apoya las recomendaciones de
la campaña sobrevivir a la sepsis de iniciar el tratamiento con la mayor
precocidad cuando está indicado, y en todo caso en las primeras 24 horas.
|
8. Sepsis
menos grave: ADDRESS |
Recientemente se han comunicado los resultados
principales del estudio ADDRESS (Administration of Drotrecogin Alfa [Activated]
in Early Stage Severe Sepsis), que requirió la FDA como estudio
post-comercialización en pacientes con sepsis grave y bajo riesgo de
muerte, con un solo órgano disfuncionante y una puntuación APACHE-II no
mayor de 24 puntos en las 24 horas previas, subgrupo que en el ensayo
PROWESS no mostró beneficio del tratamiento con PCA. En el estudio se
incluyeron pacientes con menos de 48 horas de evolución del primer fallo
de órganos. El ensayo se suspendió por ausencia de eficacia en un análisis
intermedio planificado de antemano. En total se incluyeron 2.640
pacientes, que fueron asignados aleatoriamente a recibir PCA (1.333
pacientes) o placebo (1.307). Comparados con el PROWESS, los pacientes del
ADDRESS eran más jóvenes y tenían menos gravedad. La mortalidad a los 28
días no difirió entre PCA y placebo, aunque se encontraron algunas
diferencias regionales inesperadas, y se observó un “efecto de
aprendizaje”, ya señalado en otros ensayos clínicos, por el que después de
excluir los primeros casos se pareció apreciar un beneficio con PCA. Las
complicaciones hemorrágicas fueron escasas en ambos grupos, pero fueron
significativamente más frecuentes con PCA: 2,4% frente a 1,2% a los seis
días (p = 0,02), y 3,9% frente a 2,2% a los 28 días (p = 0,01). La
frecuencia de hemorragia del sistema nervioso central y de episodios
adversos graves fue similar en ambos grupos. La eficacia del tratamiento
no se vio influida por el órgano disfuncionante.
En su conjunto, y en espera de conocerse los datos
completos, los estudios ENHANCE y ADDRESS pueden considerarse estudios
confirmatorios de la eficacia y seguridad de la PCA encontrados en el
PROWESS, de los análisis de subgrupos publicados del mismo y de las
indicaciones aprobadas del tratamiento.
|
9. EXTEND:
¿más de 96 horas? |
El curso evolutivo de la disfunción de
órganos en el estudio PROWESS y los datos conocidos del ENHANCE sugieren
que, comparados con placebo, los pacientes tratados con PCA presentan una
más rápida resolución de la disfunción de órganos, pero aún un número
importante de pacientes permanecen dependientes de fármacos vasoactivos
después de las 96 horas que dura el tratamiento. Durante la infusión se
produce también una disminución de los niveles de dímero D, aunque los
niveles no llegan a normalizarse, pero tras suspender la infusión de PCA
se produce un rebote en los niveles circulantes de dímero D, como
expresión de la persistencia del estado procoagulante. Todo lo anterior
sugiere que en muchos casos un tratamiento de 96 horas puede resultar
corto, y que la prolongación del tratamiento con PCA más allá de este
tiempo podría resultar beneficiosa. Dicha hipótesis está siendo estudiada
en la actualidad en un ensayo clínico, que se encuentra aún en fase de
reclutamiento.
El RESOLVE fue un ensayo clínico
aleatorizado y doble ciego controlado con placebo sobre la eficacia y
seguridad del tratamiento con proteína C activada en niños con sepsis
grave, y ha sido suspendido prematuramente en abril de 2005 en un análisis
intermedio después de incluir a 399 pacientes, por encontrarse altamente
improbable que consiguiera resultados positivos. Globalmente, la
mortalidad (17% con PCA y 18% con placebo), la incidencia de hemorragia
cerebral (4% y 2%), de hemorragia grave (6% y 7%) y de acontecimientos
adversos graves (17% y 20%), y el tiempo hasta la resolución completa del
fallo de órganos (9,7 y 9,8 días) fueron similares en los grupos que
recibieron PCA y placebo. En espera de conocer los datos definitivos del
estudio, sus resultados parecen consistentes con los encontrados en
adultos, en el sentido de que la PCA solo produce un beneficio apreciable
en pacientes con riesgo elevado de muerte, y los pacientes pediátricos
presentan mortalidades sustancialmente más bajas que los adultos con
sepsis grave. Los pacientes pediátricos no deben ser tratados con proteína
C activada humana recombinante.
|
11. Aspectos
prácticos de la administración de PCA |
La PCA ha sido aprobada para el tratamiento
de la sepsis grave con alto riesgo de muerte, cuando se añade a los
mejores estándares de tratamiento. Este criterio es fundamental en
el manejo de la sepsis grave, y destaca la importancia de combinar todas
las medidas terapéuticas eficaces, de manera que actúen de manera
sinérgica en beneficio del enfermo. La PCA, como ocurre con los demás
tratamientos del enfermo con sepsis, no puede por sí sola mejorar el
pronóstico de los enfermos, si no se acompaña del resto de medidas, y, por
el mismo motivo, no puede dejar de emplearse cuando está indicada.
La relación riesgo/beneficio y
coste/efectividad obligan a seleccionar cuidadosamente a los pacientes que
se pueden beneficiar del tratamiento con PCA. El análisis de subgrupos del
PROWESS ha definido las indicaciones de la PCA, restringiendo su uso a los
casos de mayor riesgo de muerte. Los datos del ENHANCE sugieren una mayor
eficacia del tratamiento cuando se administra en las primeras 24 horas de
evolución. Las guías de práctica clínica de la campaña sobrevivir a la
sepsis (CSS) y su fase de implementación, basada en los “paquetes para la
sepsis”, recogen como indicador de calidad que el tratamiento con PCA se
inicie en las primeras 24 horas de evolución, basándose en el protocolo de
cada centro.
La administración de PCA debe iniciarse una
vez completada la resucitación del paciente, con la única excepción de la
purpura fulminans meningocócica, en que, aunque no se ha
demostrado nunca, un retraso de minutos podría causar daños irreparables.
Solo una vez completada la resucitación se puede valorar el grado de
disfunción de órganos persistente tras la misma. Ha existido cierta
controversia sobre qué criterios de definición de disfunción de órganos
emplear para sentar la indicación de PCA, ya que existen varias escalas de
uso clínico, y la relación beneficio-riesgo probablemente varíe según qué
órganos sean los afectados o qué grado de disfunción presenten. Los únicos
datos de que se dispone al respecto son los del estudio PROWESS, por lo
que lo lógico parece emplear los mismos criterios que en dicho estudio
produjeron beneficio, teniendo en cuenta que la precocidad del tratamiento
exige valorar los criterios precoces de disfunción de
órganos, sin esperar a la evidencia de un fallo orgánico
establecido.
Los “paquetes para la sepsis” de la CSS han
situado de manera clara el tiempo de administración de la PCA, en las
primeras 24 horas tras el inicio de la sepsis grave, y después de la
resucitación, en que las prioridades son otras. Si por razones logísticas
no se ha podido iniciar el tratamiento en las primeras 24 horas, si existe
la indicación debería iniciarse el tratamiento lo antes posible, dentro de
las 48 horas siguientes al inicio de la sepsis grave. Pasado este plazo,
la eficacia y seguridad del fármaco no han sido evaluados, aunque se
supone que la eficacia será menor, una vez establecido el fallo de
órganos, y la indicación de PCA deberá valorarse cuidadosamente en cada
caso individual.
No se ha estudiado la administración de un
segundo curso terapéutico con PCA en pacientes que desarrollan durante su
hospitalización un segundo episodio de sepsis grave de alto riesgo.
Probablemente, la eficacia, la relación beneficio-riesgo y
coste-efectividad sean poco favorables en esta circunstancias, aunque en
todo caso la decisión de repetir el tratamiento debe valorarse
individualmente. Menos del 1% de los pacientes con sepsis grave tratados
con PCAhr desarrollan anticuerpos anti-PCA, y existe la posibilidad
teórica de que si se administra por segunda vez el fármaco pueda
producirse una reacción alérgica.
La dosis debe ajustarse cuidadosamente en
función del peso corporal del enfermo. Es recomendable utilizar
exclusivamente las tablas de dosificación y diluciones suministradas por
el fabricante para evitar errores de dosificación, no desperdiciar ni un
solo miligramo del producto y evitar infusiones de más de 12 horas, tiempo
tras el cual la infusión pierde actividad.
Ya se ha señalado que el riesgo de
hemorragia aumenta mientras dura la infusión, y sobretodo en las primeras
24 horas de la misma, siendo los principales factores de riesgo
extrínsecos los procedimientos invasivos, y los factores de riesgo
intrínsecos la trombopenia, y para la hemorragia cerebral, la trombopenia
y la meningitis. Un recuento de plaquetas inferior a 30.000 es
contraindicación al inicio del tratamiento, y, si se produce durante el
mismo, es indicación de transfusión de plaquetas. La tabla IV resume el
manejo de la infusión de PCA en relación con los procedimientos invasivos
que resulten necesarios mientras dura el tratamiento.
|
Tabla IV:
Interrupción de la infusión de PCA durante procedimientos invasivos |
|
|
|
Procedimiento |
Intervención |
|
Intervención quirúrgica,
colocación de catéter epidural, traqueostomía percutánea |
Suspender 2 horas antes y
reiniciar 12 horas después, comprobada la hemostasia |
|
Procedimientos invasivos (cateterización
venosa central, toracocentesis, toracostomía, punción lumbar, drenaje
percutáneo de abscesos, nefrostomía, paracentesis, etc) |
Suspender 2 horas antes y
reiniciar 2 horas después, comprobada la hemostasia |
|
Procedimientos invasivos menores (canulación
arterial, cambio de cánula de traqueostomía, sondaje vesical) |
Suspender 2 horas antes y
reiniciar inmediatamente, comprobada la hemostasia |
|
|
Se han definido dos grupos de pacientes con
sepsis grave que difieren claramente en su perfil evolutivo inicial, así
como en la respuesta inicial al tratamiento antibiótico y del foco de
infección [29]. Sin que esto pueda considerarse una regla absoluta, el
esquema que proponemos es el siguiente:
1. Tratamiento precoz
Existen pacientes en que el tratamiento con
PCA se debe plantear con mayor precocidad, por la evolución desfavorable
esperada a pesar de la resucitación y el control inicial del foco de
infección. En esta categoría estarían incluidas las sepsis graves de alto
riesgo producidas por purpura meningocócica, meningitis aguda, síndrome de
shock tóxico y neumonía adquirida en la comunidad, o cualquier otro
episodio séptico que curse desde el inicio con una disfunción
multiorgánica profunda en que no sea previsible una mejoría rápida.
2. Tratamiento diferido
En otros pacientes el tratamiento inicial y
el control del foco pueden acompañarse de una reversión rápida de la
disfunción multiorgánica. En estos casos, el tratamiento con PCA se
difiere, para replantearse su indicación en unas pocas horas (siempre
dentro de las primeras 24 horas), si no se ha producido una mejoría
clínica clara. Dentro de este grupo estarían incluidas las sepsis
urinarias o biliares que reciben drenaje quirúrgico o percutáneo, el
empiema que se trata con drenaje torácico, la sepsis por catéter cuando se
retira la vía, los abscesos intraabdominales que se tratan con drenaje
quirúrgico o punción percutánea, las gastroenteritis agudas u otros
procesos que cursan con una importante deshidratación o la neumonía
asociada a la ventilación mecánica, en que la valoración de la disfunción
de órganos está dificultada por las disfunciones previas y el efecto de
otras maniobras terapéuticas intercurrentes (conexión a ventilación
mecánica, episodios de desadaptación del respirador, uso de fármacos
sedantes o medicación que produce depresión hemodinámica, aparición de
arritmias, atelectasias, etc.). Cuando el control de la infección incluye
la intervención quirúrgica, como ocurre en las peritonitis, por motivos de
seguridad es necesario esperar doce horas antes de iniciar el tratamiento
con PCA, a fin de reducir el riesgo de hemorragia; este periodo de tiempo
es suficiente para valorar si la respuesta clínica ha empezado a
producirse, y, si no está siendo rápida, se debe iniciar el tratamiento.
Las indicaciones establecidas de PCA
(disfunción aguda de dos o más órganos o puntuación APACHE-II superior a
24 puntos en las 24 horas previas) se basan en análisis de subgrupos
previstos prospectivamente, y son consistentes y robustas. El criterio de
la puntuación APACHE-II es más restrictivo, y selecciona pacientes en
general con mayor riesgo de muerte que los que presentan disfunción
multiorgánica; en este subgrupo la relación coste-efectividad es mayor,
pero tiene el grave inconveniente de negar el beneficio del tratamiento a
pacientes con evidencia clara de eficacia. La actitud más recomendable,
menos restrictiva, es la de indicar el tratamiento cuando se cumple uno
cualquiera de los dos criterios, disfunción de órganos o puntuación
APACHE-II. Respecto al uso de la puntuación APACHE-II, es necesario
aclarar que no se debe esperar a que transcurran 24 horas para calcular la
puntuación, sino que se debe calcular con los valores disponibles en el
momento, con la mayor (peor) puntuación disponible de las 24 horas
anteriores.
La PCA está indicada en el tratamiento de la
sepsis grave de alto riesgo, independientemente de que se haya adquirido
en la comunidad, en el hospital o en UCI. Respecto a la sepsis secundaria
a infecciones producidas en UCI, los esfuerzos se deben centrar en la
prevención, pero su tratamiento es el mismo que el de la sepsis que motiva
el ingreso. El control de infecciones en UCI incluye la vigilancia diaria
de los pacientes en búsqueda de la aparición de signos de respuesta
inflamatoria sistémica (temperatura, frecuencia cardiaca y respiratoria,
recuento y fórmula leucocitarios) y de signos focales de infección (puntos
de entrada de catéteres, sedimento urinario, características del esputo,
radiografía de tórax), y, en algunos casos, la toma sistemática de
cultivos de vigilancia. La detección de un nuevo episodio de infección y/o
sepsis se debe seguir de la valoración del grado de disfunción orgánica
que produce; en casi todos los casos, los pacientes que desarrollan
infecciones en Cuidados Intensivos presentan disfunción de órganos previa,
que se ve agravada por el nuevo episodio infeccioso, sin que resulte fácil
distinguir en qué medida el agravamiento de la disfunción de órganos
preexistente está producida por el nuevo episodio de sepsis. En estos
casos, la indicación de proteína C activada se basa en una valoración
cuidadosa de cada caso individual.
Por último, en el paciente traumatizado con
lesión de órganos sólidos (desgarros importantes de hígado o bazo) o
lesiones pélvicas con hematoma retroperitoneal, el riesgo de hemorragia
debe ser valorado cuidadosamente si el paciente desarrolla infección
nosocomial, y se ha recomendado que no se administre PCA en la primera
semana de evolución, salvo que se haya llevado a cabo un tratamiento
quirúrgico definitivo que asegure la hemostasia local (esplenectomía).
-
La proteína C activada humana
recombinante (drotrecogina-alfa activada) es el primer tratamiento que
ha demostrado eficacia en la sepsis, viniendo a unirse al conjunto de
medidas terapéuticas que abordan los distintos aspectos de la
enfermedad: el tratamiento precoz de la infección, la resucitación
inicial agresiva y guiada por objetivos hemodinámicos explícitos, el
tratamiento con hidrocortisona del shock séptico y el mejor tratamiento
de soporte de los órganos disfuncionantes. Sólo el conjunto de medidas
consigue la mayor efectividad.
-
La PCA está indicada en los pacientes
adultos con sepsis grave y riesgo elevado de muerte, que son los que
presentan disfunción de dos o más órganos o una puntuación APACHE-II
superior a 24 puntos en las 24 horas previas, en ausencia de
contraindicaciones y cuando se añade a los mejores estándares de
tratamiento. En estos casos, la proteína C no se debe considerar una
medida opcional, sino que se debe administrar en todos los casos, en
ausencia de contraindicaciones, y debe hacerse en una fase precoz (las
primeras 24 horas) de la evolución de la enfermedad.
-
La PCA es un tratamiento seguro, si se
emplea con las precauciones recomendadas, y a pesar de su elevado precio
se considera coste-efectivo para las indicaciones aprobadas en Europa y
España.
-
La PCA no está indicada en la sepsis con
disfunción de un solo órgano y una puntuación APACHE-II inferior a 25
puntos en las 24 horas previas, y no se debe emplear en niños.
-
Palencia E. Tratamiento del
enfermo con sepsis grave. [REMI
2005; 5 (3): C3].
-
Dellinger RP, Carlet JM, Masur H, Gerlach H, Calandra T, Cohen J,
Gea-Banacloche J, Keh D, Marshall JC, Parker MM, Ramsay G, Zimmerman JL,
Vincent JL, Levy MM.
Surviving Sepsis Campaign Guidelines for the management of severe sepsis
and septic shock.
Intensive Care
Med 2004; 30: 536-555.
-
Palencia E. La proteína C
reduce la mortalidad en la sepsis grave. [REMI
2001; 1 (3): 67].
-
Bernard GR,
Vincent JL, Laterre PF, LaRosa SP, Dhainaut JF, López Rodríguez A,
Steingrub JS, Garber GE, Helterbrand JD, Ely EW, Fisher CJ.
Efficacy and
safety of recombinant human activated protein C for severe sepsis.
N Engl
J Med 2001; 344: 699-709.
-
Marshall JC.
Inflammation, coagulopathy, and the pathogenesis of multiple organ
dysfunction syndrome. Crit Care Med 2001; 29 [Suppl.]: S99-S106.
-
García de Lorenzo A, Quintana
M. Aspectos hematológicos de la sepsis grave. [REMI
2004; 4 (12): C20].
-
Vervloet MG, Thijs LG, Hack
CE. Derangements of coagulation and
fibrinolysis in critically ill patients with sepsis and septic shock.
Semin Thromb Hemost 1998; 24: 33-44.
-
Aird WC. The role of
endothelium in severe sepsis and multiple organ dysfunction syndrome.
Blood 2003; 101: 3765-3777.
-
Lorente JA,
Landín L. El sistema de la proteína C en la sepsis. Med Intensiva 2003;
27: 171-173.
-
Hotchkiss RS,
Karl IE. The pathophysiology and treatment of sepsis.
N Engl J Med 2003; 348:
138-150.
-
Dhainaut JF,
Shorr AF, Macias WL, Kollef MJ, Levi M, Reinhart K, Nelson DR.
Dynamic
evolution of coagulopathy in the first day of severe sepsis:
relationship with mortality and organ failure.
Crit Care Med
2005; 33: 341-348.
-
La Rosa SP, Opal SM.
Clinical trials
of novel anticoagulants for severe sepsis: A tale of three molecules.
Adv sepsis 2004; 4:
17-23.
-
Lyseng-Williamson
KA, Perry CM. Drotrecogin alfa (activated). Drugs 2002; 62: 617-630.
-
Macias WL, Dhainaut
JF, Yan SC, Helterbrand JD, Seger M, Johnson G 3rd, Small DS.
Pharmacokinetic-pharmacodynamic
analysis of drotrecogin alfa (activated) in patients with severe sepsis.
Clin Pharmacol Ther 2002; 72: 391-402.
-
Bernard GR, Ely
EW, Wright TJ, Fraiz J, Stasek JE Jr, Russell JA, Mayers I, Rosenfeld
BA, Morris PE, Yan SB, Helterbrand JD. Safety and dose relationship of
recombinant human activated protein C for coagulopathy in severe sepsis.
Crit
Care Med 2001;
29: 2051-2059.
-
Ely EW, Laterre
PF, Angus DC, Helterbrand JD, Levy H, Dhainaut JF, Vincent JL, Macias WL,
Bernard GR. Drotrecogin alfa (activated) administration across
clinically important subgroups of patients with severe sepsis.
Crit Care Med
2003; 31: 12-19.
-
Vincent JL,
Angus DC, Artigas A, Kalil A, Basson BR, Jamal HH, Johnson G 3rd,
Bernard GR. Effects of drotrecogin alfa (activated) on organ dysfunction
in the PROWESS trial.
Crit Care Med
2003; 31: 834-840.
-
Bernard GR,
Macias WL, Joyce DE, Williams MD, Bailey J, Vincent JL. Safety
assessment of drotrecogin alfa (activated) in the treatment of adult
patients with severe sepsis. Crit Care 2003; 7: 155-163.
-
Dhainaut JF,
Laterre PF, Janes JM, Bernard GR, Artigas A, Bakker J, Riess H, Basson
BR, Charpentier J, Utterback BG, Vincent JL. Drotrecogin alfa
(activated) in the treatment of severe sepsis patients with
multiple-organ dysfunction: data from the PROWESS trial.
Intensive Care Med
2003; 29: 894-903.
-
Angus DC, Laterre
PF, Helterbrand J, Wesley E, Ball DE, Garg R, Weissfeld LA, Bernard GR.
The
effect of drotrecogin alfa (activated) on long-term survival alter
severe sepsis.
Crit Care Med
2004; 32: 2199-2206.
-
Laterre PF,
Levy H, Clermont G, Ball DE, Garg R, Nelson DR, Dhainaut JF, Angus DC.
Hospital
mortality and resource use in subgroups of the Recombinant Human
Activated Protein C Worldwide Evaluation in Severe Sepsis (PROWESS)
trial.
Crit Care Med 2004 ;32: 2207-2218.
-
Laterre PF, Garber G, Levy H,
Wunderink R, Kinasewitz GT, Sollet JP, Maki DG, Bates B, Betty Yan SCh,
Dhainaut JF. Severe community-acquired pneumonia as a cause of severe
sepsis: data from the PROWESS trial. Crit Care Med 2005; 33:
952-961.
-
Taylor FB Jr,
Toh CH, Hoots WK, Wada H, Levi M; Scientific Subcommittee on
Disseminated Intravascular Coagulation (DIC) of the International
Society on Thrombosis and Haemostasis (ISTH). Towards definition,
clinical and laboratory criteria, and a scoring system for disseminated
intravascular coagulation.
Thromb Haemost
2001;
86:
1327-1330.
-
Sacristán JA, Prieto L, Huete
T, Artigas A, Badía X, Chinn C, Hudson P. Coste-efectividad de
drotrecogina alfa (activada) en el tratamiento de la sepsis grave en
España. Gac Sanit 2004; 18: 50-57.
-
Green C, Dinnes J, Takeda A,
Shepherd J, Hartwell D, Cave C, Payne E, Cuthbertson BH. Clinical
effectiveness and cost-effectiveness of drotrecogin alfa (activated) (Xigris(R))
for the treatment of severe sepsis in adults: a systematic review and
economic evaluation. Health Technol Assess 2005; 9: 1-140.
-
Betancourt M,
McKinnon PS, Massanari RM, Kanji S, Bach D, Devlin JW. An evaluation of
the cost effectiveness of drotrecogin alfa (activated) relative to the
number of organ system failures.
Pharmacoeconomics 2003; 21:
1331-1340.
-
Manns BJ, Lee H,
Doig CJ, Johnson D, Donaldson C. An economic evaluation of activated
protein C treatment for severe sepsis. N Engl J Med 2002; 347: 993-1000.
-
Angus DC,
Linde-Zwirble WT, Clermont G, Ball DE, Basson BR, Ely EW, Laterre PF,
Vincent JL, Bernard G, van Hout B; PROWESS Investigators.
Cost-effectiveness of drotrecogin alfa (activated) in the treatment of
severe sepsis. Crit
Care Med 2003; 31: 1-11.
-
Laterre PF,
Wittebole X. Clinical review: Drotrecogin alfa (activated) as adjunctive
therapy for severe sepsis- practical aspects at the bedside and patient
identification.
Crit Care
2003; 7: 445-450.
Eduardo Palencia Herrejón
Hospital Gregorio Marañón, Madrid
©REMI,
http://remi.uninet.edu. Junio 2005.
Palabras clave:
Sepsis grave, Proteína C activada,
Drotrecogina alfa (activada).
Busque en REMI con Google:
Envía tu comentario para su
publicación |