-
Conceptos
-
Elección
del modelo. formulación de la pregunta de investigación
-
Modelos
de endotoxinemia
-
Modelos
de infección bacteriana
-
Modelos
de peritonitis
-
Modelos
que reciben tratamiento
-
Aportación de los modelos preclínicos al conocimiento de la sepsis humana
-
Conclusión
-
Bibliografía
Sepsis es la constelación de signos, síntomas y cambios
fisiopatológicos asociados a una infección. Diferentes estímulos no
infecciosos (p. ej.: pancreatitis, isquemia-reperfusión tras cirugía
vascular, contusión pulmonar, quemaduras masivas, etc.) pueden originar
una respuesta inflamatoria en el huésped indistinguible de la originada
por una infección. Esta respuesta inflamatoria se denomina en general
síndrome de respuesta inflamatoria sistémica (SRIS). Sólo cuando el SRIS
se debe específicamente a una infección se denomina sepsis. Sepsis grave
es aquella sepsis que se acompaña de la disfunción de al menos un órgano.
Las manifestaciones clínicas del SRIS que se utilizan
como criterios para su diagnóstico son la taquicardia, la taquipnea o la
necesidad de ventilación mecánica, la leucocitosis o la leucopenia, y la
fiebre o la hipotermia. Los cambios fisiopatológicos asociados al SRIS y a
la sepsis son comunes, y consisten en una respuesta pro-inflamatoria del
huésped. En la actualidad, es imposible distinguir clínicamente el SRIS y
la sepsis, excepto en los casos en los que existe un foco infeccioso
evidente. La activación por diversos estímulos (p. ej.: restos de DNA
bacteriano o viral, detritus celulares, endotoxina, componentes de la
pared de bacterias grampositivas, etc.) de una familia de receptores de
membrana denominados Toll-like receptors es el evento molecular común al
inicio de la respuesta del huésped ante esos insultos causantes del SRIS.
Este reciente descubrimiento ha permitido explicar el hecho de que
diferentes estímulos conducen a la misma respuesta pro-inflamatoria en el
huésped.
La sepsis se asocia, pues, con diferentes cambios en la
función de los órganos inducidos por un estímulo infeccioso, en el
contexto de un ambiente pro-inflamatorio. Estos cambios incluyen: (i)
activación de diferentes sistemas de proteasas (coagulación, fibrinolisis,
complemento, elastasa neutrófila); (ii) hipoperfusión tisular; (iii)
vasodilatación sistémica, hipotensión sistémica, vasoconstricción pulmonar
y aumento del gasto cardíaco; (iv) activación de la glucolisis, lipolisis
y proteolisis; (v) una elevada mortalidad.
A la luz de estos conceptos, un modelo de sepsis
clínicamente relevante ha de reproducir una situación pro-inflamatoria en
el animal y alguno de los cambios enunciados previamente tras un estímulo
infeccioso. Además, remedando la situación clínica, debe asociarse a una
mortalidad elevada. La relevancia clínica del modelo se basa en que
reproduzca alguno de esos cambios, y en que se acompañe de una mortalidad
semejante a la sepsis grave humana de forma no aguda (es decir, a lo largo
de los días siguientes al estímulo séptico). Ningún modelo animal reproduce todos los cambios
característicos de la sepsis humana (Tabla I).
|
Tabla I.
Los modelos animales comparados a la sepsis
humana
|
|
|
|
Características |
Modelos preclínicos |
Sepsis grave/shock séptico en humanos |
|
Edad |
Jóvenes generalmente |
Adultos o ancianos |
|
Insulto |
Endotoxina o microorganismo definido |
Desconocido o microorganismos múltiples |
|
Tratamiento antibiótico |
Variable |
Siempre |
|
Tiempo del tratamiento |
Antes o poco después del insulto |
Tiempo variable después del insulto |
|
Duración del insulto |
Muy corta (aplicación de LPS en minutos) |
Prolongada (foco séptico persistente, episodios de bacteriemia) |
|
Patocronia |
Rápida |
Lenta |
|
Comorbilidad presente |
Casi nunca |
Muy frecuente |
|
Autoanticuerpos |
Desconocido |
Muy frecuente |
|
Uso de ventilación mecánica |
Variable |
Casi siempre |
|
Limpieza del ambiente |
Deficiente |
Muy limpio |
|
Coprofagia |
Frecuente |
Nunca |
|
Tolerancia a anticoagulantes |
Sí |
No |
|
|
Los primates, perros y ratas desarrollan una respuesta
hipodinámica tras el estímulo séptico. Estas especies son resistentes a la
endotoxina y requieren dosis 10-100 veces superiores a las que inducen una
respuesta en humanos. El conejo es particularmente sensible a la
endotoxina. Los cerdos también desarrollan una respuesta hipodinámica. Las
ovejas son más sensibles a la endotoxina, y la respuesta pulmonar y
cardiovascular es semejante a la de los humanos.
|
2. Elección
del modelo: formulación de la pregunta de investigación |
El modelo ha de elegirse dependiendo del objetivo que
se pretenda estudiar. Por ejemplo, si se pretende estudiar los mecanismos
de vasodilatación ha de usarse un modelo que presente disminución de la
resistencia vascular sistémica tras el estímulo. Si se pretende estudiar
la mortalidad, debe ser un modelo crónico que presente una mortalidad
significativa durante los días siguientes al estímulo.
La elección del modelo depende de otros factores como
el coste, la familiaridad del personal de investigación con diferentes
especies, la disponibilidad de las instalaciones para estabular animales
grandes, etc. Los animales pequeños (ratas, ratones, conejos) son
apropiados para estudios de mortalidad. La obtención de muestras de sangre
está limitada por el pequeño volumen sanguíneo de estos animales. Los
animales grandes son más apropiados para obtener muestras de sangre más
abundantes, y permiten una monitorización más completa (inserción de
catéter de arteria pulmonar, medición de flujos sanguíneos regionales,
etc.). El estudio de la influencia de la dotación genética sobre la
respuesta al insulto es posible en animales pequeños. Por ejemplo, el uso
de la cepa de ratas CH3/HeN, que es una cepa resistente a la endotoxina
(hoy sabemos que debido a una mutación en el Toll-like receptor 4, que
transduce los cambios inducidos por la endotoxina), ha sido de gran
utilidad para estudiar los mecanismos de acción de la endotoxina y las
bacterias gramnegativas.
La elección del modelo experimental depende de la
pregunta de investigación planteada. La pregunta plantea la medición de un
efecto (variable dependiente) mediante la alteración de otro u otros
factores (variables independientes). La pregunta debe formularse en términos
de una hipótesis que defina la población de estudio, describa
detalladamente las intervenciones, considere la magnitud del efecto
esperado de la intervención, y plantee un curso temporal de los eventos (Fig.1-4):
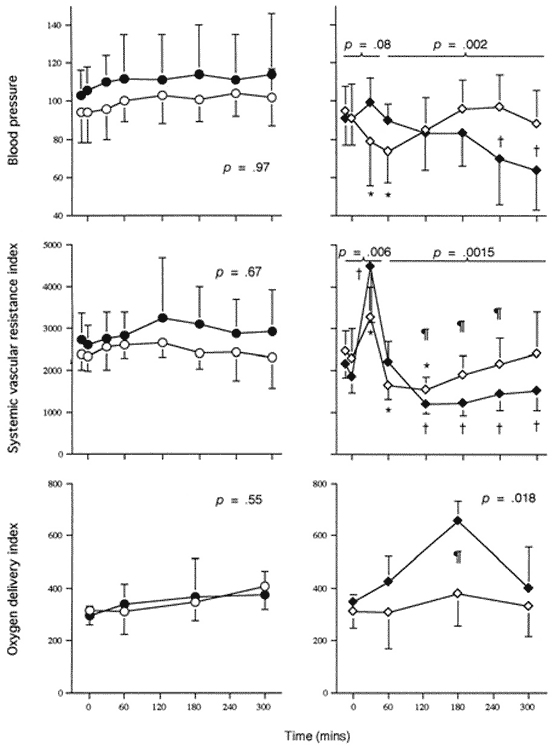
Figura 1. Cambios en diferentes variables hemodinámicas en
ovejas que han recibido en t=0 una dosis i.v. de E. coli en 30 min., y efectos del
tratamiento con L-Arginina. Se observa hipotensión transitoria, aumento
marcado seguido de una disminución de la resistencia vascular sistémica,
sin cambios en el transporte de oxígeno. El tratamiento con L-Arginina se
asocia con una mayor hipotensión, con disminución de la resistencia
vascular y con un aumento del transporte de oxígeno (debido a un aumento
del gasto cardíaco). Paneles de la izquierda: animales control. Paneles de
la derecha: animales sépticos. Símbolos vacíos: no tratados. Símbolos
llenos: tratados con L-Arginina (Lorente JA, Delgado MA, Tejedor C, Mon E, Hervás M, Pascual T,
Fernández-Segoviano P, Rieppi G, Soler A, Ayuso D, Esteban A. Modulation
of systemic hemodynamics by exogenous L-arginine in normal and bacteremic
sheep. Crit Care Med 2000; 27: 2474-2479).
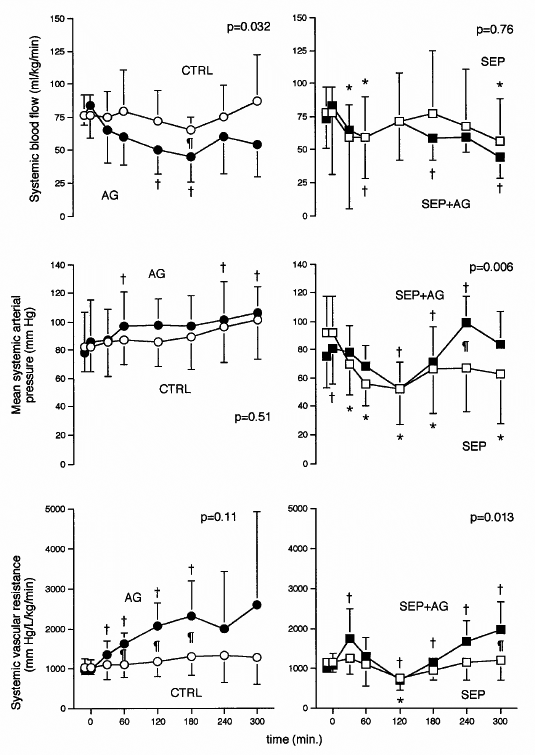
Figura
2.
Cambios en diferentes variables
hemodinámicas en ovejas que han recibido en t=0 una dosis i.v. de E. coli en 30 min.
y tratamiento con aminoguanidina (AG), un inhibidor selectivo de la NO
sintasa inducible. El tratamiento con AG atenúa la hipotensión y la
disminución de la resistencia vascular sistémica asociados a la sepsis.
Paneles de la
izquierda: animales control. Paneles de la derecha: animales sépticos.
Símbolos vacíos: no tratados. Símbolos llenos: tratados con AG
(Lorente JA, Tejedor C, Delgado MA,
Fernández-Segoviano P, Jara N, Tobalina R, Rodríguez-Corcos A, Moscoso A,
Esteban A. Hemodynamic, biochemical and morphological changes induced by
aminoguanidine un normal an septic sheep.
Intensive Care Med 2000; 26:
1670-1680).
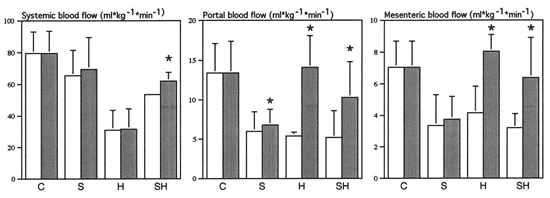
Figura 3. En cerdos sépticos (E. coli i.v.) la
administración de hemoglobina (Hb) disminuye los flujos regionales por
captación de
NO. El tratamiento con glutation (GSH) atenúa el efecto de la Hb
sobre los flujos regionales, quizá mediando reacciones de trans-nitrosilación
y aumentando la disponibilidad de NO vasoactivo. C:
control; S:
séptico; H:
no séptico tratado con Hb; SH:
séptico tratado con Hb. Barras vacías, antes de la administración del GSH.
Barra llenas, después de la administración de GSH. (Tejedor
C, Lorente JA, Delgado MA,
Fernandez-Segoviano P, De Paula M,
Tobalina R, Alonso M, Moscoso A,
Soto F, Blazquez J,
Esteban A. Interaction
between hemoglobin and glutathione in the regulation of blood flow
in normal and septic pigs.
Care Med.
2002; 30: 2493-2500).
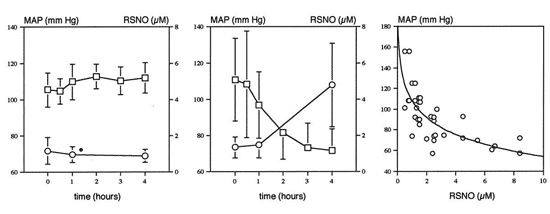
Figura 4. En cerdos sépticos (E. Coli i.v.) el desarrollo de
hipotensión se acompaña de aumento de la concentración de
nitrosotioles (RSNOs) (compuestos vasoactivos que median la
acción del NO) en el suero (Panel central). Los cambios en la presión
arterial presentan una correlación con los cambios en la concentración de
RSNOs (Panel derecho). En animales no sépticos no hay cambios en la
concentración de RSNOs ni en la presión arterial media (MAP) (Panel
izquierdo). (Tejedor C,
Lorente JA, Delgado MA,
Fernandez-Segoviano P, De Paula M,
Tobalina R, Alonso M, Moscoso A,
Soto F, Blazquez J, Esteban
A. Interaction between
hemoglobin and glutathione in the regulation of blood flow
in normal and septic pigs.
Care Med.
2002;30:2493-500).
El efecto del tiempo es crucial al considerar la
validez de los diferentes modelos. Se requiere un curso temporal para el
desarrollo de la respuesta del huésped al insulto, para que el daño
secundario al insulto progrese, para que se active la respuesta
inflamatoria, y para que la intervención terapéutica module esos procesos.
2.1. Mecanismos compensadores
La respuesta hemodinámica característica de la sepsis
humana es el desarrollo de una circulación hiperdinámica normo o
hipotensa. Esta respuesta se puede reproducir en ovejas y ratas mediante
ligadura y punción del ciego (LPC), mientras que la administración de
bacterias o endotoxina se asocia generalmente con una situación
hipodinámica. La infusión de dosis bajas de endotoxina acompañada de
resucitación con fluidos también produce una respuesta hiperdinámica [1,
2].
2.2.
Progresión de la disfunción de los órganos: efecto del tiempo
La sepsis humana se asocia con disfunción secuencial de
órganos que se presenta a lo largo del tiempo tras el insulto séptico.
Sólo los modelos que permiten una monitorización prolongada a lo largo del
tiempo ofrecen la oportunidad de estudiar la disfunción de los órganos
asociada al insulto séptico. Por ejemplo, se puede observar disfunción
orgánica en ratas durante las 96 horas tras LPC [3], y cambios en la
permeabilidad capilar pulmonar en ovejas a lo largo de 72 horas tras LPC.
Asimismo, el deterioro de la reactividad vascular y la
disminución y posterior normalización de la fracción de eyección del
ventrículo izquierdo, cambios característicos de la sepsis humana y
reproducidos en modelos animales, requieren un tiempo para desarrollarse.
Modelos en los que la mortalidad precoz sea muy elevada
o el tiempo de observación sea reducido no ofrecen la oportunidad para el
desarrollo de disfunción de órganos, y serán inadecuados para ciertos
estudios en los que se pretenda estudiar efectos de intervenciones sobre
la aparición secuencial de fallo orgánico tras el estímulo séptico.
2.3.
Activación de la respuesta inflamatoria
La respuesta inflamatoria se caracteriza por una
liberación transitoria de TNF- α,
seguida por la liberación de IL-1-β e IL-6. Asimismo, el daño intestinal
asociado a la sepsis, caracterizado por hipoperfusión e hipoxia de la
mucosa intestinal, facilita la translocación de bacterias y toxinas, lo
cual puede amplificar y perpetuar la respuesta inflamatoria durante
períodos de tiempo prolongados tras el estímulo séptico.
2.4.
Intervenciones terapéuticas
Los modelos de LPC son aptos para la evaluación de
terapias en los cambios fisiopatológicos inducidos por la sepsis. Los
modelos agudos de endotoxinemia están limitados en general a períodos
cortos de observación, y permiten evaluar el efecto de intervenciones
terapéuticas sobre cambios precoces tras el estímulo séptico.
El conocimiento en los años 50 de que la endotoxina
tiene un papel central en la fisiopatología de la sepsis llevó al
desarrollo de modelos animales en los que se intentaba reproducir algunos
cambios característicos de la sepsis mediante la administración de
endotoxina. La elevada dosis de endotoxina que se requiere para producir
estos cambios resta relevancia clínica a los modelos experimentales. La
administración es en bolos por vía intravenosa (i.v.) o intraperitoneal (i.p.). Con el objeto de facilitar
que el huésped disponga de tiempo suficiente para desarrollar una
respuesta patofisiológica al insulto, se puede administrar mediante
infusión continua a través de la implantación de una bomba de infusión
osmótica. Este modelo ofrece la ventaja adicional de que se puede estudiar
al animal consciente durante varios días.
La respuesta a la endotoxina depende de la especie, y
en algunos aspectos difiere marcadamente de la que caracteriza a la sepsis
humana. En perros, la administración de una dosis letal conduce a
hipotensión desde el primer minuto, vasoconstricción venosa hepática y
disminución del retorno venoso. La presión arterial se normaliza durante
la primera hora. Posteriormente, el gasto cardíaco y la presión arterial
disminuyen y el animal fallece en el contexto de una situación
hipodinámica [4].
Por el contrario, la administración de endotoxina a
primates subhumanos se asocia con una disminución del gasto cardíaco sin
hipotensión, y a diferencia de lo que se observa en pacientes- un aumento
de la diferencia arterio-venosa de oxígeno. La hipotensión es un evento
preterminal.
El modelo de endotoxinemia no es propiamente hablando
un modelo de sepsis, pues el estímulo que conduce a los cambios
fisiopatológicos no es infeccioso. La endotoxinemia es, pues, sensu
stricto, un modelo de inflamación sistémica, más que un modelo de sepsis.
Sin embargo, se acepta como modelo para estudiar la fisiopatología de la
sepsis, ya que la endotoxina es una molécula central en la fisiopatología
de la sepsis. En el 44% de los enfermos críticos se encuentran niveles
elevados de endotoxina [5], algunos de los cuales presentan infección por
bacterias grampositivas. En estos casos, el origen de la endotoxina
probablemente sea las bacterias gramnegativas de la luz intestinal. Los
niveles de endotoxina se relacionan con el desarrollo de disfunción
multiorgánica y con la mortalidad [6].
3.1.
Modelos de endotoxinemia en roedores
Los modelos de endotoxinemia en roedores presentan
limitaciones adicionales. Las dosis necesarias para producir shock son
10-100 veces superiores a las necesarias en humanos. A diferencia de la hiperglicemia y
el aumento persistente de la gluconeogénesis encontrada en
humanos, los roedores tratados con endotoxina presentan una hiperglicemia
transitoria que rápidamente evoluciona hacia una situación de hipoglicemia.
La hipotensión inducida por la endotoxina no se debe a vasodilatación,
como en humanos, sino que sucede en el contexto de un aumento marcado de
la resistencia sistémica [7].
Efecto de la dosis
La administración de dosis elevadas de endotoxina a
conejos (5 mg/kg) produce una situación hipodinámica, mientras que la
administración de dosis menores (1-3 mcg/kg) induce una respuesta
hiperdinámica semejante a la observada en humanos [8, 9]. En ratas se han
encontrado diferencias semejantes [10, 11].
La mortalidad a las 48 horas puede ser fácilmente
manipulable mediante la dosis, desde 10% con 5 mg/kg en bolus i.p. hasta 80%
con 20 mg/kg en bolus i.p.
Efecto de la duración de la administración
La administración a ratas de 5 mg/kg en bolus i.p. se
asocia con una mortalidad a las 48 horas del 10%, mientras que la misma dosis
i.p. administrada en 24 horas se asocia con una mortalidad del 0%. La misma
dosis i.v. de 5 mg/kg se asocia con una mortalidad del 0% o del 90%, según
se administre a lo largo de 24 horas o de 4 horas [12, 13].
También se ha descrito un modelo de sepsis inducido por
la administración i.v. continua de endotoxina, con el objeto de remedar la
situación clínica de endotoxinemia continua. La administración i.v. de
endotoxina a la dosis de 3 mg/día produce hipercatabolismo e hipotensión,
y es apropiado para el estudio de cambios metabólicos y cardiovasculares
[14].
Vía
de administración
La administración i.v. de endotoxina en ratas produce
una elevación marcada y transitoria de la concentración de endotoxina en
el suero, mientras que la administración por vía i.p. produce una
elevación más progresiva durante las 3 horas siguientes al estímulo [15].
Modelos de sensibilización
La sensibilidad a la endotoxina aumenta mediante la
administración previa de ciertos agentes como la D-Galactosamina. Dosis de
100 mcg/kg produce en ratas sensibilizadas una mortalidad semejante
(alrededor del 90% a las 48 horas) que dosis de 15 mg/kg en ratas no
sensibilizadas. Los niveles de TNF a las 2 horas (50 ng/ml) son semejantes en
ratas sensibilizadas y no sensibilizadas, mientras que los niveles de
endotoxina son mil veces inferiores (70 ng/ml versus 70.000 ng/ml)
[16, 17]. Este fenómeno se debe a la sensibilización de los hepatocitos al
efecto de citoquinas inducidas por la endotoxina, particularmente el TNF- α.
La administración de anticuerpos anti-TNF disminuye la mortalidad de ratas
sensibilizadas que reciben 100 mcg/kg de endotoxina i.p. al 0% [18].
La sensibilización a los efectos de la endotoxina se
puede conseguir también mediante la administración previa de plomo,
muramil-dipéptido o mediante la inducción de una infección por bacterias
gramnegativas.
3.2.
Endotoxinemia en ovejas
A diferencia de otras especies (primates, perros,
roedores) la oveja es notablemente sensible a la endotoxina, y presenta
cambios cardiovasculares y pulmonares semejantes a los encontrados
en pacientes con sepsis [19].
El pulmón de la oveja es, junto con el del caballo, el
más semejante anatómicamente al humano. El hecho de que el ganglio
linfático mediastínico caudal recoge, prácticamente sin contaminación
sistémica, sólo linfa pulmonar permite, mediante la medición del flujo
linfático, estimar en la ecuación de Starling-Pappenheimer cuál es el
flujo transvascular de fluido. Por eso, el modelo de fístula linfática
pulmonar crónica se ha establecido como el modelo ideal para el estudio
del flujo transvascular pulmonar en condiciones de bacteriemia o
endotoxinemia. Numerosos estudios han demostrado que la administración de
pequeñas dosis de endotoxina (1 mcg/kg) o de bacterias produce un aumento
del flujo transvascular pulmonar [20]. Ese modelo ha permitido identificar
dos fases en los cambios circulatorios pulmonares tras la administración
de endotoxina. La fase inicial se caracteriza por hipertensión
pulmonar debida a un aumento de la presión hidrostática capilar y
elevación del tromboxano A2, con formación de edema pobre en proteínas
[21]. En una segunda fase el edema pulmonar se debe a un aumento de la
permeabilidad y la presión en la arteria pulmonar disminuye.
3.3.
Endotoxinemia en humanos
A diferencia de las ratas, los conejos y los humanos
son muy sensibles a pequeñas dosis de endotoxina. La administración de 4
ng/kg iv induce un cuadro gripal en 90 min., fiebre y taquicardia, que
alcanzan un máximo a las 2-3 horas, y un aumento de la concentración sérica de ACTH y
adrenalina. Se puede detectar un aumento del TNF desde el minuto
90, que alcanza un máximo a las 3 horas, y es indetectable a las 4 horas. Los
niveles de IL-6 e IL-8 alcanzan un pico a las 3 horas post-endotoxina,
mientras que los niveles de IL-1-β e IFN-γ no cambian. La respuesta
hemodinámica consiste en hipotensión, aumento del gasto cardíaco y
disminución de la resistencia vascular, cambios que son máximos a las 3 horas
post-endotoxina [22-25]. Entre los cambios cardiovasculares que pueden
ser relevantes para la respuesta humana a la sepsis se encuentra una
disminución de la fracción de eyección del ventrículo izquierdo.
La endotoxinemia se asocia con un pico de actividad
t-PA a las 2 horas post-endotoxina, que desaparece hacia la hora 3, seguida de
un aumento de la actividad PAI, que alcanza un máximo a las 4-5 horas y
desaparece hacia la hora 24 post-endotoxina. El aumento del PAI coincide
con la aparición de signos de activación de la coagulación. El perfil
coagulopático consiste, pues, en una activación transitoria de la
fibrinolisis seguida de una fuerte inhibición de la fibrinolisis durante
las horas en que la coagulación se encuentra máximamente activada. Todos
estos cambios favorecen la formación de depósitos de fibrina en la
microcirculación.
Los cambios hemodinámicos y bioquímicos se normalizan a
las 9 horas tras el estímulo séptico.
4.1.
Infección bacteriana en roedores
La administración de bacterias por diversas vías en
roedores puede reproducir varios cambios característicos de la sepsis
humana. Sin embargo, su relevancia clínica está limitada por el hecho de
que estos insultos consisten en la administración de dosis muy elevadas de
bacterias, en modelos en los que el huésped es incapaz de localizar la
infección, a diferencia de lo que suele ocurrir en la situación clínica.
La administración de E. coli vivos en dosis de 1010 UFC a cobayas
induce una respuesta hipo o hiperdinámica, según que la administación sea
i.v. o subcutánea. [26, 27, 28].
La inyección de bacterias vivas por vía oral o i.p.
induce un estado de sepsis en las ratas. Dependiendo del germen, de la
dosis y de la suspensión en la que se vehiculizan los gérmenes, la
mortalidad puede ser nula [7], o del 100% en 48 horas [29, 30].
4.2.
Modelo de bacteriemia en ovejas y cerdos
Tanto las ovejas como los cerdos se caracterizan por
presentar disfunción pulmonar tras la administración i.v. de bacterias.
Este cambio, que no se observa en perros y roedores, se debe probablemente
a la presencia de macrófagos intravasculares pulmonares [31].
En el modelo porcino no se ha podido inducir una
respuesta hiperdinámica a pesar de una resucitación con fluidos agresiva
[32]. En ovejas, la infusión de P. aeruginosa o endotoxina a lo largo de
30-60 min. se asocia con una respuesta hiperdinámica tras una corta
respuesta hipodinámica. La administración de dosis más elevadas de
bacterias origina únicamente una respuesta hipodinámica.
4.3.
Modelo de bacteriemia en primates
El modelo de sepsis en primates ofrece la ventaja de
que, debido a la proximidad filogenética de estas especies con el hombre,
la respuesta cardiovascular y respiratoria es semejante a la presentada
por los humanos. Además, existe reactividad cruzada con numerosas
moléculas humanas, lo cual facilita la determinación de su concentración.
[33, 34].
La administración intravenosa de E. coli en primates
anestesiados, traqueostomizados y monitorizados hemodinámicamente produce
una bacteriemia que es aclarada de la circulación en 15 minutos tras la
interrupción de la infusión [35]. Los microorganismos persisten en los
tejidos a las 8 horas de la infusión i.v., pero no a las 72 horas post-infusión.
La infusión i.v. de E. coli en dosis de 2x1010 UFC durante 8 horas en
animales anestesiados y resucitados con Ringer lactato (RL) 5 ml/kg/h. al principio del
experimento, y RL 18-35 ml/kg/hr hacia el final del experimento, se asocia
con una respuesta hiperdinámica caracterizada por taquicardia, hipotensión
y aumento del gasto cardíaco. Otros cambios encontrados fueron leucopenia,
trombopenia, acidosis e hipoxemia. También se observa liberación de
proteasas (elastasa, catepsina, colagenasa), activación del complejo
terminal del complemento y activación de C3, y signos bioquímicos de
coagulación intravascular diseminada. El modelo se acompaña de necrosis
tubular aguda, hepatocitolisis y colestasis. El hígado, pulmón, adrenales
e intestino delgado presentan en el examen histológico edema, hemorragia y
signos de coagulación intravascular.
Si la dosis administrada de E coli es menor y durante
un período de tiempo de infusión más corto (5x108 UFC/kg durante 2 horas), se
observa, en comparación con el modelo utilizando una dosis mayor, una
menor hipotensión y un menor aumento del gasto cardíaco. Los cambios
bioquímicos y morfológicos, y en la función de los órganos son menos
marcados.
Con el objeto de estudiar el efecto sobre la mortalidad
de intervenciones farmacológicas, se ha diseñado un modelo subcrónico
consistente en la administración de E coli (2x109 UFC/kg i.v.) durante 2
horas, retornando el animal a su jaula, donde continua intubado,
recibiendo fluidos y soporte ventilatorio si se requiere, durante un
período de observación de 72 horas. La mortalidad de este modelo es elevada,
en torno al 80-90%.
Con el objeto de simular la situación clínica en la que
el paciente puede sufrir repetidos episodios de bacteriemia, se ha
diseñado un modelo subcrónico en el que el animal recibe 3 dosis de E. coli
(1x108 UFC/kg. el primero, seguido de dos administraciones de 5x107 UFC/kg)
cada 24 horas. Este modelo se asocia con una mortalidad del 50-60%, menor y
más tardía a la asociada a la dosis única mayor.
En resumen, el modelo agudo de bacteriemia en
primates es adecuado para el estudio de cambios hemodinámicos asociados al
shock séptico. El modelo subcrónico es pertinente para el estudio de
terapias que tengan un impacto sobre la mortalidad, así como para el
análisis de cambios bioquímicos y morfológicos, que requieren un mayor
período de tiempo para su desarrollo.
5.1.
Peritonitis inducida mediante implantación de bacterias vivas o material
fecal
Otro modelo experimental de sepsis consiste en la
administración i.p. de bacterias vivas o material fecal. La inoculación
fecal de ratas produce una respuesta hipermetabólica y es letal durante
los siguientes 5 días [36]. La administración i.p. de bacterias vivas en
cultivo puro o con un adyuvante produce bacteriemia. Sin embargo, de la
misma forma que la endotoxinemia, en este modelo el huésped no tiene
oportunidad de localizar la infección y desarrollar una respuesta completa
compensatoria.
Se puede inducir peritonitis mediante la implantación
de cápsulas de gelatina que contienen sulfato de bario y heces. El sulfato
de bario es un irritante que aumenta la respuesta inducida por las
bacterias. Este modelo se asocia con una elevada mortalidad a las 72 horas
[37].
La peritonitis en perros inducida mediante la
implantación de un coágulo infectado se realiza mediante la colocación
en el peritoneo de un coágulo de fibrina que contiene bacterias gramnegativas. El animal puede ser mantenido despierto durante días,
sometido a tratamiento antibiótico y a resucitación con fluidos. La
respuesta cardiovascular consiste en hipotensión, disminución del gasto
cardíaco y resistencia vascular sistémica normal, que evoluciona hacia una
situación de aumento del gasto cardíaco, normotensión y disminución de la
resistencia vascular. La fracción de eyección del ventrículo izquierdo disminuye tras la implantación del coágulo,
alcanzando un mínimo al día 2-3, para luego nomalizarse hacia el día 7.
El modelo permite el estudio de la respuesta de la
función cardiovascular a diferentes dosis del estímulo séptico y a
diferentes intervenciones terapéuticas [38-40].
5.2.
Modelo de ligadura y punción del ciego
La ligadura del ciego produce una peritonitis debido a
necrosis del ciego. Sin embargo, estudios posteriores [41, 42] demostraron
que las ratas forman en torno al área necrótica un absceso tabicado que
toleran considerablemente bien, sin mostrar mortalidad en períodos de
seguimiento de hasta un mes.
La punción del ciego antes de retornar el intestino a
la cavidad permite el paso de flora intestinal al peritoneo de una forma
continua, dando lugar a una peritonitis por un mecanismo similar al que
presentan los enfermos con perforación intestinal. El modelo es, pues, de
gran relevancia clínica, y presenta una mortalidad fácil de manipular
variando el tamaño de las perforaciones intestinales.
Estos animales presentan bacteriemia y, debido a la
naturaleza del insulto, tienen tiempo de desarrollar una respuesta. Se
observa una respuesta hiperdinámica durante las primeras 12 horas tras la LPC,
que evoluciona a un estado hipodinámico hacia la hora 16-24, presentando
hiperlactatemia, hipoglucemia, y una mortalidad del 95% a las 72 horas.
El modelo es de gran utilidad para estudiar cambios
metabólicos y hemodinámicos de la sepsis, así como para analizar cambios
en la mortalidad inducidos por diversos tratamientos.
Para optimizar los modelos de sepsis es fundamental
considerar si el animal es tratado de forma similar a un paciente,
incluyendo la reposición de volumen, la antibioterapia y el tratamiento
quirúrgico.
La reposición de volumen es esencial para mantener la
circulación y el funcionamiento de los órganos. En los modelos de
endotoxemia, la fluidoterapia modifica la supervivencia y las
características hemodinámicas, y en los modelos con perforación influye de
manera significativa en la respuesta inmunológica [43-45]. En la mayoría
de los estudios de LPC en ratas se administra un bolo único o bolos
repetidos de salino fisiológico 30-60 ml/kg. por vía subcutánea [46-50].
Para remedar de forma más precisa la situación clínica, en algunos modelos
se administra una infusión continua tras el bolo inicial [51-54].
En los animales grandes se puede administrar una dosis
de fluidos fija [55-57] o ajustar la dosis de manera individual [58-61].
La ausencia de fluidoterapia en los modelos de sepsis
causa interacciones serias entre la sepsis y el shock hipovolémico
subsiguiente. La fisiopatología y la función inmune varían
significativamente si se administra o no fluidoterapia [62]. A pesar de
ello, algunos autores evitan la administración de fluidos para controlar
mejor las condiciones experimentales, aunque esto ponga en peligro la
validez de los resultados [63].
La administración de antibióticos se puede hacer con
dos objetivos: comprobar la eficacia de los mismos en el desarrollo de la
sepsis [64-66] y hacer el modelo más clínicamente relevante [67-71].
El diseño experimental en un modelo tratado con fluidos
y antibióticos sirve de guía para el diseño de ensayos clínicos
posteriores y así conseguir resultados más válidos que cuando se emplean
nuevas estrategias en animales no tratados.
La intervención quirúrgica es una parte fundamental del
tratamiento de la sepsis. Por eso, algunos modelos consisten en un
estímulo séptico acompañado de un tratamiento quirúrgico, que consiste en
la excisión quirúrgica del foco infeccioso y el lavado peritoneal tras LPC
[72-75].
|
7. Aportación
de los modelos preclínicos de sepsis al conocimiento de la sepsis
humana |
Los modelos pre-clínicos de sepsis han contribuido
definitivamente al conocimiento de numerosos aspectos de la sepsis humana.
No se pueden revisar aquí de forma exhaustiva todos los conocimientos
sobre la sepsis que están originados en el estudio de modelos animales,
sino sólo aquellos que son más relevantes, particularmente algunos de los
que han conducido al diseño de ensayos clínicos.
7.1.
Tratamientos anti-inflamatorios
Como es sabido, en casi todos los ensayos clínicos
sobre terapias anti-inflamatorias en humanos (inhibidores de la ciclo-oxigenasa,
antagonistas de la IL-1, anticuerpos anti-TNF, antagonistas de la
histamina, etc.) se encuentra en pequeño pero no significativo efecto
beneficioso asociado a la intervención. Sólo analizando todos los estudios
de forma conjunta se encuentra que las diferentes intervenciones
meta-analizadas se asocian con un efecto estadísticamente significativo
sobre la mortalidad [76-79]. El diseño de estos ensayos clínicos estuvo
basado en estudios pre-clínicos en los que se demostraba el papel central
de estas moléculas en la respuesta del huésped a la infección, y en el
hallazgo de que intervenciones que atenúan esta respuesta inflamatoria se
asocian con una mejor supervivencia.
Nosotros hemos revisado todos los estudios realizados
en modelos experimentales de sepsis que analizaron los efectos de terapias
anti-TNF. Este análisis ha resultado de gran interés, pues permite
identificar en esos estudios pre-clínicos áreas de eficacia que fueron
posteriormente encontradas en los ensayos clínicos. Tal es el caso de la
mayor eficacia del tratamiento anti-TNF en infecciones bacterianas
gramnegativas en comparación con infecciones grampositivas [80, 81].
Otro hallazgo de interés [80] fue que, si bien los
estudios pre-clínicos que estudian los efectos de anticuerpos anti-TNF
demuestran eficacia, aquellos en los que se utilizan animales manipulados
genéticamente (como animales deficientes en el gen del TNF, deficientes
en el receptor soluble del TNF, o deficientes en el receptor del TNF) no
encontraron efecto protector (la mortalidad en el grupo deficiente no era
inferior a la del grupo normal). Este hallazgo recuerda el resultado de
que en los ensayos clínicos en que se utilizaron dosis elevadas de
receptores solubles del TNF la mortalidad empeoró respecto al grupo
control [76].
Asimismo, hemos encontrado que el tratamiento anti-TNF
está en relación con la mortalidad del grupo control: si la mortalidad es
inferior al 50%, el tratamiento produce daño; si la mortalidad es superior
al 50%, el tratamiento produce beneficio [80]. Este hallazgo también ha
sido encontrado en ensayos clínicos humanos. Hay por lo menos tres
tratamientos probados en ensayos clínicos en humanos cuyo efecto sobre la
mortalidad está en relación con el efecto del tratamiento: el tratamiento
con el antagonista del receptor de la IL-1, con proteína C activada y con
anticuerpos monoclonales anti-TNF [81-84].
7.2.
Tratamientos anticoagulantes
Estudios en animales y en humanos demostraron que la
sepsis se acompaña de un estado sistémico procoagulante, sentando las
bases para la hipótesis de que la inhibición de la coagulación en la
sepsis humana puede asociarse con una mejor supervivencia [85-91].
El efecto de la terapia anticoagulante en la sepsis
grave ha sido estudiada en ensayos clínicos que han investigado el efecto
de la administración de los tres anticoagulantes endógenos fisiológicos
(la antitrombina III, la proteína C activada [PCA] y el inhibidor de la
vía del factor tisular [TFPI]) [84, 89]. Como es conocido, sólo el
tratamiento con PCA demostró eficacia, con un NNT de 16 para salvar una
vida en la población de estudio, y un NNT de aproximadamente 6 para salvar
una vida en aquellos pacientes de mayor gravedad de acuerdo con el número
de órganos en disfunción o la puntuación APACHE II (que son aquellos para
los que existe aprobación en Norteamérica y en Europa).
7.3.
Tratamientos hemodinámicos
El estudio de los mecanismos de hipotensión en la
sepsis experimental ha permitido identificar el papel central de la
inducción de la óxido nítrico (NO) sintasa inducible (iNOS) en la
hipotensión inducida por la endotoxina o por la sepsis. Mientras que el NO
liberado en condiciones fisiológicas por la NO sintasa constitutiva (cNOS)
resulta necesario para mantener una homeostasis normal en el huésped, el
aumento de la expresión de iNOS en la sepsis conduce, entre otros cambios,
a una vasodilatación excesiva y a daño en la función celular mediante la
formación de peroxinitrito, al reaccionar el NO con el radical superóxido
[92-99].
Un ensayo clínico en fase II sobre los efectos de la
L-N-monometil-arginina (LNMMA) en pacientes con shock séptico demostró que
esta intervención se asociaba con una mayor proporción de enfermos en los
que el shock se resuelve a las 72 horas. En base a estos resultados
esperanzadores, se diseño un ensayo clínico en fase III para analizar los
efectos de esta intervención sobre la mortalidad [100]. Probablemente
debido a cambios en el protocolo, que permitían aumentar la administración
de LNMMA a dosis mayores y de forma más rápida, se encontró que el
tratamiento se asociaba de hecho a una mayor mortalidad.
Posteriormente se encontró en estudios preclínicos que
la inhibición selectiva de la iNOS, respetando la acción de la cNOS,
mediante la determinados agentes que presentan una mayor afinidad por la
iNOS que por la cNOS, se asocia a una mejor superviviencia en la sepsis.
Sería de gran interés probar esta hipótesis en pacientes con sepsis
[94, 95].
7.4.
Tratamiento ventilatorio
Los modelos de daño pulmonar agudo han permitido
describir hace años el concepto de que el pulmón sufre un daño
inflamatorio cuando es sometido a un estrés cíclico inducido por el uso de
volúmenes corrientes elevados [101, 102]. Estudios posteriores encontraron
que bajo estas condiciones ventilatorias se induce una situación de
inflamación sistémica. Estos conocimientos pre-clinicos sentaron las
bases para el diseño de un ensayo clínico que comparara el uso de dos
volúmenes corrientes en pacientes con síndrome de distrés respiratorio
agudo o daño pulmonar agudo. Este estudio encontró una mayor supervivencia
en los enfermos ventilados con volúmenes corrientes bajos [103].
Interesantemente, ambos grupos no se diferenciaron en el deterioro de la
oxigenación, sino en la duración del fracaso de órganos no pulmonares y en
la duración del shock.
Estos conocimientos han conducido a la elaboración de
recomendaciones sobre pautas ventilatorias en pacientes con sepsis que
potencialmente minimicen el desarrollo de disfunción multiorgánica y
mejoren la supervivencia.
El avance en el conocimiento de la sepsis y de terapias
eficacias ha sido posible sólo gracias al desarrollo de modelos pre-clínicos
de sepsis [104, 105]. Ningún modelo reproduce en todos sus aspectos a la
sepsis humana. Sin embargo, cada modelo experimental permite estudiar al
menos los aspectos de la sepsis humana que el animal reproduce.
Aun cuando todo los modelos presentan limitaciones
importantes, es sorprendente la contribución que han hecho al conocimiento
de aspectos fisiopatológicos y terapéuticos de la sepsis humana.
Revisiones sistemáticas de estudios en animales han permitido alcanzar
conclusiones que se asemejan a los resultados de ensayos clínicos.
Las recomendaciones para el tratamiento de la sepsis
grave están basadas en ensayos clínicos que fueron diseñados en base a un
gran cuerpo de conocimiento procedente de estudios pre-clínicos.
El estudio de la sepsis en modelo pre-clínicos continúa
siendo extraordinariamente necesario para avanzar en el conocimiento de la
biología de la sepsis humana y en el diseño de estrategias terapéuticas
eficaces.
-
Fish RE,
Burns AH, Lang CH, Spitzer JA. Myocardial dysfunction in a nonlethal,
nonshock model of chronic endotoxinemia. Circ Shock 1985; 16: 241-252.
-
Curtis SE,
Cain SM. Regional and systemic oxygen delivery/uptake relations and
lactate flux in hyperdynamic, endotoxin-treated dogs. Am Rev Respir Dis
1992; 145: 348-345
-
Stahl TJ,
Alden PB, Rings WS, Madoff RF, Cerra FB. Sepsis-induced diastolic
dysfunction in chronic canine peritonitis. Am J Physiol
1990; 258: H625-H633.
-
MacLean LD,
Weil MH. Hypotension (shock) in dogs produced by Escherichia coli
endotoxin. Circ Res 1956; 4: 546-556.
-
Danner RL,
Elin RJ, Reilly JM, Hosseini JM, Schlesinger TL, Parrillo JE.
Endotoxemia in human septic shock. Crit Care Med 1988; 16: 317-323.
-
Aasen AO,
Rishovd AL, Stadaas JO. Role of endotoxin and proteases in multiple
organ failure. Progr Clin Biol Res 1989; 308: 305-314.
-
Perkash I,
Satpati P, Agawal KC, Chakravarti RN, Chutani PM. Prolongad peritoneal
lavage and fecal peritonitis. Surgery 1970;68:842-845, Martinez LA,
Quintiliani R, Milton RC. Clinical experience on the detection of
endotoxemia with the limulus test. J Infect Dis 1973; 127: 102-105.
-
Wyler F,
Neutze JM, Rudolph AM. The effects of endotoxin on distribution of
cardiac output in unanesthetized rabbits. Am J Physiol 1970; 219: 246-251.
-
Fink MP,
Morrissey PE, Stein KL, Clement RE, Fiallo V, Gardiner WM. Systemic and
regional hemodynamic effects of cyclo-oxygenase and thromboxane
synthetase inhibition and and hyperdynamic endotoxemic rabbits. Circ
Shock 1988; 26: 41-57.
-
Rackett 1985,
Law WR, Ferguson JL. Naloxone alters organ perfusion during endotoxin
shock in conscious rats. Am J Physiol 1988; 255: H1106-1113.
-
Johnston TD,
Hamptono WH, Fry DE. E. coli endotoxin produces hyperdynamic
hemodynamics in the rat. Circ Shock 1989; 27: 320.
-
Bahrami S,
Schiesser A, Redl H, Schlag G. Comparison of different corticosteroids
in rat endotoxemia. Prog Clin Biol Res 1987; 236: 273-286.
-
McKechnie K,
Furman BL, Parratt JR. Metabolic and cardiovascular effects of endotoxin
infusion in conscious unrestrained rats: effects of methylprednisolone
and BW755C. Circ Shock 1985; 15: 205-215.
-
Fish RE,
Spitzer JA. Continuous infusion of endotoxin from a osmotic pump in the
conscious, unrestrained rat: a unique model of chronic endotoxemia. Circ
Shock 1984; 12: 135-149.
-
Emerson TE,
Fourniel MA, Leach WJ, Edens TB. Protection against disseminated
intravascular coagulation and death by antithrombin III in the
Escherichia coli endotoxemic rat. Circ Shock 1987; 21: 1-14.
-
Freudenberg
MA, Galanos C. Induction of tolerance to lipopolysaccharide (LPS) D-Galactosamine
lethality by pretreatment with LPS is mediated by macrophaes. Infect
Immun 1988; 56: 1352-1357.
-
Freudenberg
MA, Galanos C. Tumor necrosis factor alpha mediates lethal activity of
killed gramnegative and gram positive bacteria in D-galactosamine
treated mice. Infect Immun 1991; 59: 2110-2115.
-
Bahrami S,
Redl H, Buurman WA, Schlag G. Endotoxin shock related disorders
induced by high- versus low-dose lipopolysaccharide (LPS) injection in
rats. Eur Surg Res 1991; 23: S1-60.
-
Traber DL,
Redl H, Schlag G, Herndon DN, Kimura R, Prien T, Traber LD.
Cardiopulmonary responses to continuous administration of endotoxin. Am
J Physiol 1988; 254: H833-H839.
-
Demling RH,
Manohar M, Hill JA. Response of the pulmonary microcirculation to fluid
loading after hemorrhagic shock and resuscitation. Surgery
1980; 87: 552-559.
-
Adams TJ,
Traber DL. The effects of a prostaglandin synthetase inhibitor,
ibuprofen, on the cardiopulmonary response to endotoxin in sheep. Circ
Shock 1982; 9: 481-489.
-
Parker MM,
Shelhamer JH, Bacharach SL, et al. Profound but reversible myocardial
depression in patients with septic shock. Ann Intern Med
1984; 100: 483-490.
-
Parker MM,
Suffrediini AF, Natanson C, Ognibene FP, Shelhamer JH, Parrillo JE.
Responses of left ventricular function in survivors and nonsurvivors of
septic shock. J Crit Care 1989; 4: 19-25.
-
Suffredini
AF, Fromm RE, Parker MM, Brenner M, Kovaks JA, Wesley RA, Parrillo JE.
The cardiovascular response of normal humans to the administration of
endotoxin. N Engl J Med 1989; 321: 280-287.
-
Parker MM,
Shelhamer JH, Natanson C, Alling DW, Parrillo JE. Serial cardiovascular
variables in survivors and nonsurvivors of human septic shock: heart
rate as an early predictor of prognosis. Crit Care Med 1987; 15: 923-929.
-
Durkot MJ,
Wolfe RR. Hyper and hypodynamic models of sepsis in guinea pigs. J Surg
Res 1989; 46: 118-122.
-
Sato T,
Isoyama T, Tanaka J, Jones RT, Cowley RA, Trump BF. The pathophysiology
of septic shock: changes in hemodynamics in rats following live E. coli
injection. An application of the thermodilution method for measurement
of cardiac output. Adv Shcok Res 1982; 7: 25-34.
-
Pass LJ,
Schloerb PR, Pearce FJ, Drucker WR. Cardiopulmonary response of the rat
to gram-negative bacteremia. Am J Physiol 1984; 246: H344-H350.
-
Ahrenholz DH,
Simmons RL. Fibrin and peritonitis I. Beneficial and adverse effects of
fibrin in experimental E. coli peritonitis. Surgery 1980; 88: 41-47.
-
Oderdonk AB,
Weinstein WM, Sullivan NM, Gorbach SL. Experimental intraabdominal
abscesses in rats: quantitative bacteriology of infected animals. Infect
Imunn 1974; 10: 1256-1259.
-
Dehring DJ,
Wismar BL. Intravascular macrophages in pulmonary capillaries of man. Am
Rev Respir Dis 1989; 139: 1027-1029.
-
Mustard RA,
Fisher J, Hayman S, Matlow A, Mullen JBM, Odumeru J, Roomi MW, Scouten
BD, Swanson HT. Cardiopulmonary responses to Pseudomonas septicemia in
swine: an improved model of the adult respiratory distress syndrome. Lab
Anim Sci 1989; 39: 37-43.
-
Hinshaw LB.
Application of animal shock models to the human. Circ Shock
1985; 17: 205-212.
-
Simon GL,
Galfand GA, Connolly RA, O´Donnell TF, Gorbach SL. Experimental
bacteroides fragilis bacteremia in a primate model: evidence that
bacteroides fragilis does not promote the septic shock síndrome. J
Trauma 1985; 25: 1156-1162.
-
Schlag G,
Redl H, Hallström S, Radmore K, Davies J. Hyperdynamic sepsis in baboons:
I. Aspects of hemodynamics. Circ Shock 1991; 34: 311-318.
-
Lang CH,
Bagby GJ, Bornside GH, Vial LJ, Spitzer JJ. Sustained hypermetabolic
sepsis in rats: characterization of the model. J Surg Res
1983; 35: 201-210.
-
Weinstein WM,
Onderdonk AB, Barlett JG. Experimental intraabdominal abscesses in rats.
Development of an experimental model. Infec Immun 1974; 10: 1250-1255.
-
Natanson C,
Fink MP, Ballantyne HK, McVittie TJ, Conklin JJ, Parrillo JE. Gram-negative
bacteremia produces both severe systolic and diastolic cardiac
dysfunction that simulates human septic shock. J Clin Invest
1986; 78: 259-70.
-
Fink MP,
MacVittie TJ, Casey LC. Inhibition of prostaglandin synthesis restores
normal hemodynamics in canine hyperdynamic sepsis. Ann Surg
1984; 200: 619-626.
-
Natanson C,
Danner RL, Fink MP, MacVittie TJ, Walker RI, Conklin JJ, Parrillo JE.
Cardiovascular performance with E. Coli challenges in a canine model of
human sepsis. Am J Physiol 1988; 254: H558-H564.
-
Wichterman K,
Baue AE, Chaudry IH. Sepsis and septic shock- a review of laboratory
models and a proposal. J Surg Res 1980; 29: 189-201.
-
Fink MP,
Heard SO. Laboratory models of sepsis and septic shock. J Surg Res
1990; 49: 186-196.
-
Redl H,
Bahrami S, Schlag G, Traber DL. Clinical detection of LPS and animal
models of endotoxemia. Inmunobiol. 1993; 187: 330-345.
-
Fink MP,
Kaups KL, Wang H, Rothschild HR. Maintenance of superior mesenteric
arterial perfusion prevents increased intestinal mucosal permeability in
endotoxic pigs. Surgery 1991; 110: 153-160.
-
Wilson MA,
Chou MC, Spain DA, Downard PJ, Quian Q, Cheadle WG, Garrison RN. Fluid
resuscitation attenuates early citokyne mRNA expression after
peritonitis. J Trauma 1996; 41: 622-627.
-
Wichterman
KA, Baue AE, Chaudry IH. Sepsis and septic shock. A review of laboratory
models and a proposal. J Surg Res 1980; 29: 189-201.
-
Read TE,
Grunfeld C, Kumwenda ZL, Calhoun MC, Kane JP, Feingold KR, Rapp JH.
Triglyceride-rich lipoproteins prevent septic death in rats. J Exp Med
1995; 182: 267-272.
-
Tang C, Liu
MS. Initial externalization followed by internalization of β-adrenegic
receptors in rat heart during sepsis. Am J Physiol 1996; 270: R254-R263.
-
Chen SJ, Wu
CC, Yen MH. Alterations of ex vivo vascular reactivity in
intraperitoneal sepsis. J Cardiovasc Pharmacol 1994; 24: 786-793.
-
Wang P, Ba ZF,
Chaudry IH. Endotelium-dependent relaxation is depressed at the macro
and microcirculatory levels during sepsis. Am J Physiol
1995; 269: R988-R994.
-
Martin CM,
Sibbald WJ, Modulation of hemodynamics and organ blood flow by nitric
oxide synthase inhibition is not altered in normotensive, septic rat. Am
Respir Crit Care Med 1994; 150: 1539-1544.
-
Fox GA,
Paterson NAM, McComark DG. Cyclooxygenase inhibition and vascular
reactivity in a rat model of hyperdinamic sepsis. Am J Physiol
1994; 267: H1377-H1382.
-
Piper RD,
Pitt-Hyde M, Li F, Sibbald WJ, Potter RF. Microcirculatory changes in
rat skeletal muscle in sepsis. Am J Respir Crit Care Med
1996; 154: 931937.
-
Farquhar I,
Martin CMM, Lam C, Potter R, Ellis CG, Sibbald WJ. Decreased capillary
density in vivo in bowel mucosa of rats with normotensive sepsis. J Surg
Res 1996; 61: 190196.
-
Goldfarb RD,
Glock D, Kumar A, McCarthy RJ, Mei J, Guynn T, Matushek M, Trenholme G,
Parrillo JE. A porcine model of peritonitis and bacteremia simulates
human septic shock. Shock 1996; 6: 442451.
-
Arvidsson D,
Almquist P, Haglund U. Effects of Positive end-expiratory pressure on
splanchnic circulation and function in experimental peritonitis. Arch
Surg 1991; 126: 631-636.
-
Fox GA,
Berstein A, LamC, Neal A, Rutledge FS, Inman K, Sibbald WJ. Hematocrit
modifies the circulatory control of systemic and myocardial oxygen
utilization in septic
-
Walker JF,
Cumming AD, Lindsay RM, Solez K, Linton AL. The renal response produced
by nonhypotensive sepsis in a large animal model. Am J Kidney Dis
1986; 8: 88-97.
-
Cumming AD,
Nimmo GR. Hemodynamic, renal and hormonal actions of aprotinin in an
ovine model of septic shock. Crit Care Med 1992; 20: 1134-1139.
-
Hersch M:
Gnidec AA, Bersten AD, Troster M, Rutledge FS, Sibbald WJ. Histologic
and ultrastructural changes in nonpulmonary organs during early
hyperdynamic sepsis. Surgery 1990; 107: 397-410.
-
Fox GA, Lam
CJ, Darragh WB, Neal AM, Inman KJ, Rutledge FS, SibbaldWJ. Circulatory
sequelae of administering CPAP in hyperdynamic sepsis are time dependent.
J Appl Physiol 1996; 81: 976-984.
-
Burchard KW,
Simms HH, Robinson A, DiAmico R, Gann DS. Hypocalcemia during sepsisRelationship
to resuscitation and hemodynamics. Arch Surg 1992; 127: 265- 272.
-
Barke RA,
Birklid S, Chapin RB, Roy S, Brady PS, Brady LJ. The effect of surgical
treatment following peritoneal sepsis on hepatic gene expression. J Surg
Res 1996; 60: 101-106.
-
Wilkins
TD,Walker CB, Nitzan D, Salyers AA. Experimental infections with
anaerobic bacteria in mice. J Infect Dis 1977; 135: S13-S17.
-
Kresta A,
Shek PN, Odumeru J, Bohnen JMA. Distribution of free and liposome-encapsulated
Cefoxitin in experimental intra-abdominal sepsis in rats. J Pharm
Pharmacol 1993; 45: 779-783.
-
Weinstein WM,
Onderdonk AB, Bartlett JG, Louie TJ, Gorbach SL. Antimicrobial therapy
of experimental intraabdominal sepsis. J Infect Dis 1975; 132: 282-286.
-
DeMarsh PL,
Wells GI, Lewandowski TF, Frey CL, Bhatnagar PK, Ostovic EJR. Treatment
of experimental gram-negative and gram-positive bacterial sepsis with
the hemoregulatory peptide SK&F 107647. J Infect Dis 1996; 173: 203-211.
-
Remick D,
Manohar P, Bolgos G, Rodriguez J, Moldawer L, Wollenberg G. Blockade of
tumor necrosis factor reduces lipopolysaccharide lethality, but not the
lethality of cecal ligation and puncture. Shock 1995; 4: 89- 95.
-
Hotchkiss RS,
Karl IE. Calcium: A regulator of the inammatory response in endotoxemia
and sepsis. New Horiz 1996; 4: 58-71.
-
Aranow JS,
Zhuang J, Wang H, Larkin V, Smith M, Fink MP. A selective inhibitor of
inducible nitric oxide synthase prolongs survival in a rat model of
bacterial peritonitis: Comparison with two nonselective strategies.
Shock 1996; 5: 116-121.
-
Cameron EM,
Zhuang J, Nenconi MJ, Phipps R, Fink MP. Dantrolene, an inhibitor of
intracellular calcium release, fails to increase survival in a rat model
of intraabdominal sepsis. Crit Care Med 1996; 24: 1537-1542.
-
Donnenberg
MS: Pathogenic strategies of enteric bacteria. Nature
2000; 406: 768-774.
-
Whang EE,
Dunn JC, Mahanty H, McFadden DW, Zinner MJ, Ashley SW. Endotoxin
inhibitor prevents sepsisinduced alterations in intestinal ion
transport.Am J Surg 1996; 172: 341-344.
-
Refsum SE,
Halliday MI, Campbell G, McCaigue M, Rowlands BJ, Boston VE. Modulation
of TNF® and IL-6 in a peritonitis model using Pentoxifylline. J Ped Surg
1996; 31: 928-930.
-
Wang P, Ba ZF,
Reich SS, Zhou M, Holme KR, Chaudry IH. Effects of nonanticoagulant
heparin on cardiovascular and hepatocellular function after hemorrhagic
shock. Am J Physiol 1996; 270: H1294-H1302.
-
Zeni F,
Freeman B, Natanson C. Anti-inflammatory therapies to treat sepsis and
septic shock: A reassessment. Crit Care Med 1997: 25: 1095-1100.
-
Marshall JC.
Clinical trials of mediator-directed therapy in sepsis: what have we
learned? Intensive Care Med 2000; 26: S75-S83.
-
Marshall JC.
Such stuff as dreams are made of: mediator-directed therapy in sepsis.
Nature Drug Discovery 2003; 2: 391-405.
-
Opal S,
Laterre PF, Abraham E, Francois B, Wittebole X, Lowry S, Dhainaut JF,
Warren B, Dugernier T, Lopez A, Sanchez M, Demeyer I, Jauregui L,
Lorente JA, McGee W, Reinhart K, Kljucar S, Souza S, Pribble J. Trial of
Platelet-Activating Factor Acetylhydrolase in Severe Sepsis
Investigators. Recombinant human platelet-activating factor
acetylhydrolase for treatment of severe sepsis: Results of a phase III,
multicenter, randomized, double-blind, placebo-controlled, clinical
trial. Crit Care Med 2004; 32: 332-341.
-
Lorente JA,
Marshall JC. Can pre-clinical models predict the effects of anti-TNF
therapy in sepsis? (2005, manuscrito en preparación).
-
Panacek EA,
Marshall JC, Albertson TE, Johnson DH, Johnson S, MacArthur FD, Miller
M, et al. Efficacy and safety of the monoclonal anti-tumor necrosis
factor antibody F(ab´)2 fragment afelimomab in patients with severe
sepsis and elevated interleukin-6 levels. Crit Care Med
2004; 32: 2173-2182.
-
Opal SM,
Fisher CJ Jr, Dhainaut JF, Vincent JL, Brase R, Lowry SF, Sadoff JC,
Slotman GJ, et al. Confirmatory interleukin-1 receptor antagonist trial
in severe sepsis. A phase III double-blind, placebo-controlled,
multicenter trial. The I L-1 Receptor Antagonist Study Investigator
Group. Crit Care Med 1997; 25: 115-124.
-
Fisher CJ Jr,
Dhainaut JF, Opal SM, Pribble JP, Balk RA, Slotman GJ, Iberti TJ, et al.
Recombinant human interleukin-1 receptor antagonist in the treatment of
patients with sepsis syndrome. Results from a randomized, double/blind,
placebo/controlled trial. Pahse III rhIL/1ra Sepsis Syndrome Study Group.
JAMA 1994; 271: 1836-1843.
-
Bernard GR,
Vincent JL, Laterre PF et al. Efficacy and safety of recombinant human
Activated Protein C for severe sepsis. N Engl J Med 2001; 344: 699-709.
-
Garcia-Avello
A, Lorente JA, Cesar-Perez J, Garcia-Frade LJ, Alvarado R, Arevalo JM,
Navarro JL, Esteban A. Degree of hypercoagulability and
hyperfibrinolysis is related to organ failure and prognosis after burn
trauma. Thromb Res 1998; 89: 59-64.
-
Lorente JA,
Garcia-Frade LJ, Landin L, de Pablo R, Torrado C, Renes E, Garcia-Avello
A. Time course of hemostatic abnormalities in sepsis and its relation to
outcome. Chest 1993; 103: 1536-1542.
-
Levi M.
Sepsis and the coagulation system. Advances in Sepsis 2000; 1: 16-22.
-
Garcia-Frade
LJ, Lorente JA, Garcia-Avello A, de Pablo R, Landin L. Plasminogen
activator inhibitor-1 levels determine the profibrinolytic response in
disseminated intravascular coagulation. Am J Hematol 1992; 41: 303-304.
-
Warren BL,
Eid A, Singer P et al. Caring for the critically ill patient. High-dose
antithrombin III in severe sepsis: A randomized controlled trial. JAMA
2001; 286: 1869-1879.
-
Dhainaut JF,
Yan SB, Margolis BD, Lorente JA, Russell JA, Freebairn RC, Spapen HD,
Riess H, Basson B, Johnson G 3rd, Kinasewitz GT; PROWESS Sepsis Study
Group. Drotrecogin alfa (activated) (recombinant human activated protein
C) reduces host coagulopathy response in patients with severe sepsis.
Thromb Haemost. 2003; 90: 642-53.
-
Taylor FB Jr,
Chang A, Esmon CT et al. Protein C prevents the coagulopathic and lethal
effects of Escherichia coli infusion in the baboon. J Clin Invest
1987; 79: 918-925.
-
Landin L,
Lorente JA, Renes E, Canas P, Jorge P, Liste D. Inhibition of nitric
oxide synthesis improves the vasoconstrictive effect of noradrenaline in
sepsis. Chest. 1994; 106: 250-256.
-
Lorente JA,
Landin L, De Pablo R, Renes E, Liste D. L-arginine pathway in the sepsis
sy ndrome. Crit Care Med. 1993; 21: 1287-1295.
-
Liaudet L,
Soriano FG, Szabo C. Biology of nitric oxide signaling. Crit Care Med
2000; 28: 37-52.
-
Lorente JA,
Tejedor C, Delgado MA, Fernandez-Segoviano P, Jara N, Tobalina R,
Rodriguez-Corcos A, Moscoso A, Esteban A. Hemodynamic, biochemical and
morphological changes induced by aminoguanidine in normal and septic
sheep. Intensive Care Med 2000; 26: 1670-1680.
-
Lorente JA,
Delgado MA, Tejedor C, Mon E, Hervás M, Pascual T, Fernández-Segoviano
P, Rieppi G, Soler A, Ayuso D, Esteban A. Modulation of systemic
hemodynamics by exogenous L-arginine in normal and bacteremic sheep.
Crit Care Med 2000; 27: 2474-2479.
-
Lorente JA,
Tejedor C, Fernández-Segoviano P, Delgado MA, Tobalina R, Mon E, et al.
Interaction between exogenous purified hemoglobin and the low molecular
weigth glutathion in the regulation of vascular tone in normal and
septic pigs. Crit Care Med 2002; 30: 2493-2495.
-
Lorente JA,
Landin L, Renes E, De Pablo R, Jorge P, Rodena E, Liste D. Role of
nitric oxide in the hemodynamic changes of sepsis. Crit Care Med
1993; 21: 759-767.
-
Lorente JA,
Landin L, Canas P, Delgado MA, Albaya A, Renes E, Jorge P, Liste D.
Effects of nitric oxide synthase inhibition on the cardiovascular
response to low output shock. Crit Care Med 1996; 24: 482-487.
-
Lopez A,
Lorente JA, Steingrub J, Bakker J, McLuckie A, Willatts S, Brockway M,
Anzueto A, Holzapfel L, Breen D, Silverman MS, Takala J, Donaldson J,
Arneson C, Grove G, Grossman S, Grover R. Multiple-center,
randomized, placebo-controlled, double-blind study of the nitric oxide
synthase inhibitor 546C88: effect on survival in patients with septic
shock. Crit Care Med 2004; 32: 21-30.
-
Dreyfuss D,
Basset G, Soler P et al. Intermittent positive-pressure hyperventilation
with high inflation pressures produces pulmonary microvascular injury in
rats. Am Rev Respir Dis 1985; 132: 880-884.
-
Dreyfuss D,
Saumon G. Ventilator-induced lung injury: lessons from experimental
studies. Am J Respir Crit Care Med 1998; 157: 294-323.
-
The acute
respiratory distress syndrome network. Ventilation with lower tidal
volumes as compared with traditional tidal volumes for acute lung injury
and the acute respiratory distress syndrome. N Engl J Med. 2000;
342: 1301-1308.
-
Freise H,
Brückner UB, Spiegel HU. Animal models of sepsis. J Invest Surg
2001; 14: 195-212.
-
Esmon CT. Why do animal models of sepsis
(sometimes) fail to mimic human sepsis. Crit Care Med 2004; 32: S219-S222.
Natalia Ramos, Fundación de Investigación Biomédica
José A. Lorente Balanza, Servicio de Medicina
Intensiva
Hospital
Universitario de Getafe, Madrid
©REMI,
http://remi.uninet.edu. Mayo 2005.
Palabras clave:
Sepsis, Shock séptico, Modelos experimentales.
Busque en REMI con Google:
Envía tu comentario para su
publicación |