|
Complicaciones
pleuropulmonares de la esofaguectomía
[Versión para
imprimir]
La mortalidad y la morbilidad de los
pacientes sometidos a cirugía de carcinoma de esófago continúa siendo
elevada, a pesar de los avances en las técnicas quirúrgicas y a las mejoras
en los cuidados que reciben estos enfermos, en el postoperatorio en las
Unidades de Cuidados Intensivos. Según las series [1, 2] hasta
el 40% desarrollan durante el postoperatorio algún tipo de complicación,
siendo las respiratorias las más frecuentes (21-37%) y las que más influyen
en la mortalidad precoz. Además, estos pacientes presentan una serie de
características especiales que aumentan el riesgo de presentar complicaciones
respiratorias [3]:
-
Patología Previa:
Frecuentemente estos enfermos tienen historia de tabaquismo, alcoholismo,
patología pulmonar crónica (EPOC) y malnutrición
[2, 4]. Por tanto,
en muchos casos la función pulmonar (FEV1) está afectada en la
evaluación prequirúrgica con el consiguiente riesgo de complicaciones
respiratorias durante la cirugía y/o en el postoperatorio
[2, 3, 5]. La
quimioterapia y radioterapia preoperatorias
podrían también jugar un papel en las complicaciones tras la cirugía,
aunque esto no está del todo claro [2, 6].
-
Mecánica Pulmonar:
La toracotomía produce una alteración en la mecánica de la caja torácica y
por tanto en la distensibilidad pulmonar, dando lugar a una disminución de
la capacidad vital, del volumen residual, la capacidad pulmonar total y la
capacidad residual funcional. Se produce una alteración en la reserva
ventilatoria y en el intercambio gaseoso como consecuencia del cierre de
las pequeñas vías aéreas y de trastornos en el cociente ventilación/perfusión
[3]. También la vía
de abordaje quirúrgica se relaciona con el número de complicaciones
respiratorias, siendo éstas más frecuentes después de la técnica de
esofaguectomía transtorácica que tras la transhiatal
[4].
La insuficiencia respiratoria aguda
se define como el cociente
presión parcial de oxígeno arterial/fracción inspirada de oxígeno (PaO2/FiO2)
menor de
200 mmHg
o una frecuencia respiratoria
superior a 30 por minuto con imposibilidad
para mantener una saturación de 02
mayor del 90% con mascarilla y
concentración de O2
mayor de 35% (excepto los pacientes con EPOC) o
necesidad de soporte ventilatorio [7].
Dependiendo de las series [2]
su incidencia varía entre el 7 y el 27%. Entre las causas que la producen se
encuentran:
1.- Atelectasia Representa el 85% de todas las
complicaciones pulmonares en el postoperatorio de la cirugía esofágica. Se
debe a la obstrucción de la vía aérea ante la incapacidad para toser y
movilizar secreciones bronquiales, generalmente por hipoventilación
secundaria a la disminución de la movilidad diafragmática por un inadecuado
control del dolor o sedación. Otras causas incluyen: broncospasmo, edema,
compresión pulmonar por aire o colecciones pleurales mal drenadas,
inadecuada fisioterapia respiratoria y/o humidificación del O2
administrado, deshidratación, etc. Tienen elevado riesgo de infección y
progresión hacia una neumonía. Para evitar
las atelectasias, el drenaje postural, las percusiones y el espirómetro de
incentivo con inspiraciones forzadas profundas, deben comenzar en el período
preoperatorio y en el postoperatorio precoz, coincidiendo con el momento de
máxima analgesia. Es muy raro el uso del fibrobroncoscopio para su
resolución. El tratamiento con mucolíticos (N-acetilcisteína) no ha
demostrado una disminución en la producción de esputo ni de la incidencia de
atelectasias en el postoperatorio de cirugía toraco-abdominal [3, 6,
7].
En el reciente trabajo de Jaber y
col. [8] se ha demostrado como el empleo de
ventilación mecánica no invasiva (modo CPAP: continuous positive airway
pressure) administrada con sistema de mascarilla tipo Helmet, en
el tratamiento de la insuficiencia respiratoria aguda secundaria a
atelectasias, del postoperatorio de cirugía abdominal electiva (incluidas
esofaguectomía y gastrectomía), disminuye en un 8,7% el riesgo absoluto de
reintubación. El único inconveniente a esta terapia se basa en el temor a
someter las suturas de las anastomosis a presiones altas, con el
consiguiente riesgo de dehiscencia. Por tanto, es necesario una adecuada
selección de los pacientes antes de instaurar este tipo de soporte
ventilatorio.
2.- Derrame pleural
Es la segunda complicación más
frecuente. El mecanismo de producción tiene lugar como resultado de un
disbalance entre la producción y la reabsorción del líquido pleural, por
ejemplo durante la sobrecarga de volumen endovenoso, al aumentar las
presiones hidrostáticas y elevarse las presiones capilares de la circulación
pulmonar. La insuficiencia cardiaca como causa de derrame pleural en estos
pacientes es muy rara; de hecho los pacientes durante las primeras horas del
postoperatorio suelen tener alteraciones del volumen circulante con
presiones cardíacas de llenado bajas, en relación con la hemorragia
secundaria a la cirugía, deshidratación o falta de líquidos por
pérdidas insensibles, proporcionales a la duración de la intervención, así
como por la propia vasoplejia que produce la anesesia. También la
desnutrición, frecuente en estos pacientes, provoca el descenso de la
presión oncótica por hipoproteinemia (hipoalbuminemia), favoreciendo los
derrames. En algunos trabajos se muestra como la mejora de los parámetros
nutricionales en el preoperatorio, incluso con nutrición parenteral, se
relaciona con menor número de complicaciones respiratorias tras la cirugía.
El aumento de la permeabilidad en la microcirculación pleural y las
alteraciones en el drenaje linfático también lo pueden favorecer.
Generalmente el derrame es estéril y puede ser unilateral o bilateral
(Fig.1). Aunque la mayoría se resuelven espontáneamente, hasta el 17% de los
pacientes precisan un drenaje pleural extra. Su persistencia o reaparición
en el postoperatorio más allá del 4º día, nos debe alertar hacia alguna de
las siguientes complicaciones: dehiscencia de sutura, sección del conducto
torácico o hemorragia pleural [6, 8].
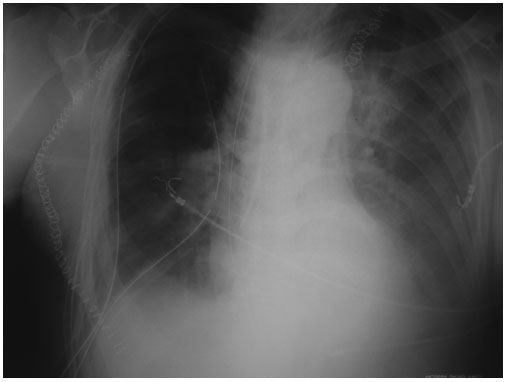
Figura 1.
Postoperatorio de carcinoma de esófago de un paciente en ventilación
espontánea con importantes derrames pleurales bilaterales, siendo el
izquierdo mayor que el derecho, asociado a atelectasias bibasales.
3.- Empiema
La infección del líquido
pleural o empiema es una complicación poco frecuente, pero potencialmente
mortal. Entre las causas más habituales se encuentran la dehiscencia de la
sutura quirúrgica a nivel torácico, que provoca la fuga del contenido
gastrointestinal a la pleura y al mediastino produciendo el empiema y la
mediastinitis respectivamente. Secundariamente los pacientes pueden
desarrollar graves complicaciones como sepsis, shock séptico, síndrome de
distrés respiratorio
agudo (SDRA) y fallo multiorgánico. Es más
frecuente en casos de cirugía esofágica con anastomosis cervical,
hemorragias importantes intraoperatorias, neumonía asociada a ventilación
mecánica (NAVM) y SDRA [9].
4.- Neumotórax
Puede ser debido a una
hiperpresión pulmonar, como resultado de la intubación selectiva y de la
obstrucción del circuito espiratorio. Otras veces está en relación con una
efracción pleural o de manera retardada, tras el destete del respirador. Se
debe verificar que no sea la traducción de una dehiscencia de la anastomosis
intratorácica, lo que generalmente se acompaña de enfisema subcutáneo y/o
derrame pleural. También los pacientes que desarrollan SDRA y son ventilados
con presiones elevadas en la vía aérea pueden desarrollar un neumotórax como
complicación (barotrauma) [1, 2, 3,
4, 10].
5.- Neumonitis química
Durante la
maniobra de intubación orotraqueal o mientras se realiza la ventilación
selectiva de un pulmón durante la propia cirugía, se puede producir la
aspiración pulmonar de contenido orofaríngeo. También después de la
extubación, cuando los pacientes no pueden restaurar su reflejo protector de
la tos para aclarar las secreciones, por ejemplo en anastomosis altas con
tiempo quirúrgico cervical. En estos casos además se puede lesionar el
nervio laríngeo recurrente que inerva el músculo cricofaríngeo y la laringe
no puede elevarse normalmente durante las primeras semanas, con el
consiguiente reflujo gastroesofágico y aspiración pulmonar de secreciones
orales. En los casos más graves, puede evolucionar hacia un SDRA y/o
neumonía secundaria por contaminación [4, 5, 6].
6.- Neumonía
nosocomial
La neumonía nosocomial
postoperatoria es la complicación clínica más importante y la principal
causa de muerte precoz tras la esofaguectomía (50%). Su incidencia varía
según las series entre el 15% y 32% [5, 11]. Es
la primera causa de reintubación y conexión a ventilación mecánica en los
primeros cinco días del postoperatorio [6]. En
más de la mitad de las muestras obtenidas crecen Enterobacterias y
Pseudomonas.
La neumonía asociada a ventilación
mecánica (NAVM) es un tipo específico de neumonía nosocomial, que pueden
desarrollar los pacientes que están en ventilación mecánica más de 48 horas
de manera continuada. Su incidencia es del 1% por día durante el primer mes
de ventilación. Se desarrolla como consecuencia de la traslocación
bacteriana, la alteración de la función gastrointestinal y la aspiración de
secreciones contaminadas con organismos patógenos que parecen adquirirse por
vía endógena. Estos patógenos alcanzan la vía distal mediante el reflujo y
aspiración mecánica de contenido gástrico contaminado y también mediante la
inoculación repetitiva de secreciones de la vía aérea superior hacia el
árbol traqueobronquial distal. Suelen ser polimicrobianas (Pseudomonas
aeruginosa, Acinetobacter spp. y Staphylococcus aureus). El diagnóstico
de la NAVM puede ser difícil dado que existen otras causas de fiebre e
infiltrados pulmonares, como las atelectasias y la Lesión Pulmonar Aguda
(LPA), con quien se debe hacer el diagnóstico diferencial [3, 6, 7]
(Fig. 2 y 3).
A pesar de la múltiple literatura
publicada sobre estrategias de prevención de la NAVM, los expertos continúan
sin ponerse de acuerdo. Varias medidas utilizadas de rutina aún no han
logrado ser validadas, mientras que otras con gran evidencia no son todavía
aceptadas. La elevación de la cabecera de la cama hasta 45º se asoció con
una reducción del reflujo gastroesofágico, así como de los episodios de
aspiración y por tanto de la incidencia de la NAVM (grado de evidencia IIa).
El uso de camas oscilantes en pacientes quirúrgicos y el uso de sucralfato
en lugar de antagonistas H2 obtiene un grado I. La aspiración de
secreciones subglóticas obtiene un grado IIa. En un metaanálisis realizado
sobre la descontaminación selectiva del tracto digestivo (DDS) encuentran
una reducción significativa de la NAVM (nivel de evidencia I). También se
recomienda retrasar el cambio de las tubuladuras del ventilador. En la
actualidad, se plantea la selección de pacientes a quienes deben aplicarse
tales medidas [12, 13].
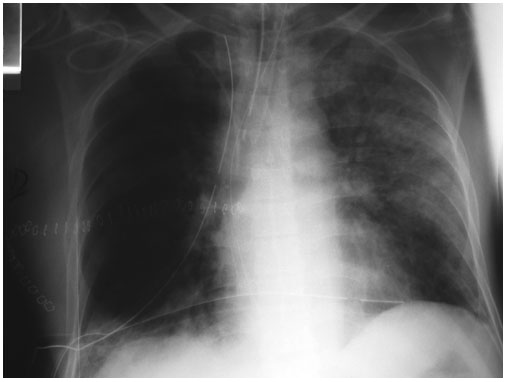
Figura 2.
Paciente intubado y conectado a ventilación mecánica en el 5º día
postoperatorio de carcinoma de esófago. Presenta un infiltrado alveolar con broncograma aéreo en todo el pulmón izquierdo compatible con bronconeumonía.
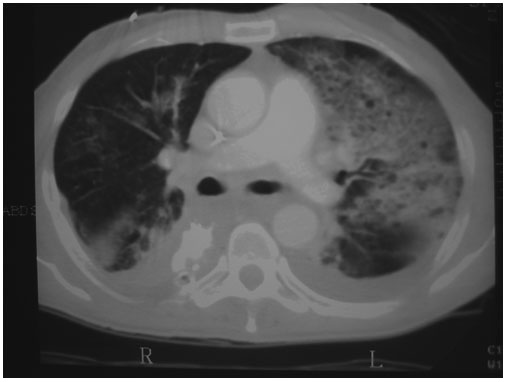
Figura 3.
Tomografía computerizada del mismo paciente. En el pulmón izquierdo se
visualizan infiltrados alveolares compatibles con proceso de consolidación
neumónica junto con pequeños derrames pleurales bilaterales posteriores.
7.- Síndrome de
distrés respiratorio agudo (SDRA)
Según la Conferencia de
Consenso Americana-Europea de 1994
[14] los criterios
clínicos que definen el SDRA son: hipoxemia aguda, PaO2/FiO2
≤200 mmHg (independientemente del nivel de presión positiva al final
de la espiración [PEEP]) e infiltrados pulmonares bilaterales en la
radiografía, una vez descartada la neumonía y el fallo ventricular izquierdo
[1, 3, 12] (Fig. 4).
La fisiopatología del SDRA se caracteriza por un trastorno de la
permeabilidad endotelial y de la barrera alveolo-capilar, que produce
importante edema rico en proteínas que colapsa los alveolos.
Entre el 9% y 50% de los
pacientes sometidos a cirugía de carcinoma de esófago desarrollan un SDRA en
el postoperatorio [2, 3, 6].
Se considera ésta la complicación respiratoria más grave, alcanzando una
mortalidad del 50% en relación con disfunción multiorgánica e hipoxemia
refractaria [2].
Durante la esofaguectomía transtorácica suele
realizarse ventilación selectiva de un sólo pulmón. El pulmón dependiente
recibe todo el volumen tidal y la mayoría de la circulación pulmonar, por lo
que está sometido a altos volúmenes que podrían resultar en una lesión
pulmonar inducida por el ventilador (liberación de mediadores inflamatorios)
y durante la reexpansión el pulmón no dependiente está expuesto a la lesión
conocida como isquemia-reperfusión. Estos dos mecanismos también se han
relacionado con el desarrollo de SDRA en el postoperatorio de esta cirugía
[2, 10].
Varios estudios han comparado los resultados de la extubación precoz o
tardía después de la esofaguectomía y han demostrado que la ventilación
mecánica en el período postoperatorio, también está asociada con una mayor
incidencia de SDRA [1, 2, 8].
La neumonía de cualquier tipo (broncoaspiración, infección pulmonar difusa
bacteriana) es la causa más frecuente. Otras causas que pueden precipitar un
SDRA son la sepsis de cualquier origen, pancreatitis aguda y la
politransfusión. Respecto a este último punto, es cierto que cada vez se le
da más importancia. Se ha demostrado que la realización de transfusiones de
hemoderivados durante el acto quirúrgico se acompaña de una situación de
inmunosupresión postoperatoria que se produce en el receptor conocido
como efecto TRIM (TRIM effect: transfusion-related
immunomodulation), y que está íntimamente ligada al tiempo de
almacenamiento de la sangre. Esto podría explicar el incremento del riesgo de
las infecciones nosocomiales, incluso cuando se transfunde una mínima
cantidad de sangre. Y aunque la transfusión es útil en situaciones de
pérdidas masivas y en las hemodiluciones graves, su eficacia para disminuir
la deuda tisular de oxígeno no ha sido documentada de manera consistente.
Además también se ha asociado a mecanismos no inmunes que producen daño
tisular y disfunción orgánica como es el edema pulmonar asociado a la
transfusión de sangre (TRALI: transfusion-related acute lung
injury) causante de SDRA como se ha comentado previamente y que en la
actualidad está siendo objeto de múltiples estudios. Por ello, se tiende a
limitar al máximo las necesidades de hemoderivados, disminuyendo el umbral
transfusional a hemoglobina de 7,5 gr/dl y el tiempo de almacenamiento a
menos de 15 días [14, 15, 16].
En
1a actualidad, ya han sido aceptadas por la comunidad científica las
estrategias ventilatorias de protección pulmonar en el SDRA, mediante la
ventilación con volumen tidal bajo (6-8 ml/kg), como único tratamiento de
eficacia probada, que disminuye la mortalidad al evitar no sólo la
sobredistensión sino la apertura y el cierre cíclico del pulmón (cizallamiento),
uno de los factores fundamentales que influyen en el daño asociado a la
ventilación mecánica [10].
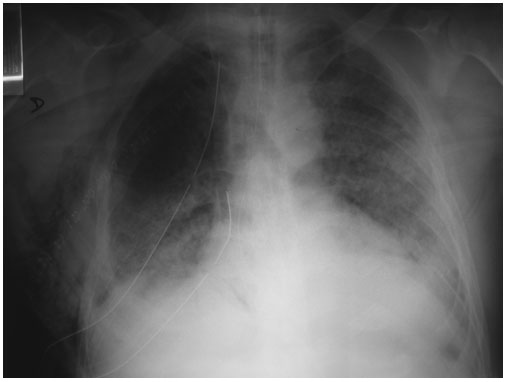
Figura 4. Paciente
con ventilación mecánica en el 12º día del postoperatorio de neoplasia de
esófago. Presenta un patrón alveolar bilateral compatible con SDRA. Derrame
pleural izquierdo con atelectasias basales bilaterales. Importante enfisema
subcutáneo.
Se ha referido la extubación
precoz como un método eficaz para minimizar las complicaciones respiratorias
[2]. Hasta el 95% de
los pacientes pueden ser extubados en las primeras 12 horas del
postoperatorio. En este sentido la
analgesia epidural se ha mostrado como el tratamiento más eficaz para
controlar el dolor y promover la fisioterapia respiratoria, mejorando así la
función pulmonar y reduciendo el número de complicaciones respiratorias.
Además, su uso mejora la microcirculación digestiva y por tanto la
oxigenación de los tejidos, sobretodo en la cirugía del tracto
gastrointestinal superior como es la cirugía del esófago. En algunos
estudios, incluso se sugiere que la analgesia epidural podría disminuir el
riesgo de dehiscencia de suturas y fístulas [2, 9]. Aún así, la reintubación
de estos pacientes una vez extubados tras la intervención quirúrgica, ocurre
en un 10% de los casos.
Bibliografía
-
Seller-Pérez G,
Herrera-Gutierrez M E, Lebrón-Gallardo M. Complicaciones precoces y
pronóstico de los pacientes con carcinoma esofágico sometidos a cirugía.
Med Intensiva 2004; 28: 408-411.
-
Chandrashekar MV, Irving M, Wayman J,
Raimes SA, Linsley A. Immediate
extubation and epidural analgesia allow safe management in a
high-dependency unit after two-stage esophagectomy. Results of eight years
of experience in a specialized upper gastrointestinal unit in a district
general hospital. Br J Anaesth 2003; 90: 474-479.
-
Montejo JC, García de Lorenzo A, Ortiz Leyba C,
Bonet A. Manual de Medicina Intensiva. 2ª edición. Madrid: Ediciones
Harcourt, 2001: 576-580.
-
Amar
D. Cardiopulmonary complications of esophageal surgery.
Chest Surg Clin N Am 1997; 7:
449-456.
-
Atkins B Z, Shah A S, Hutcheson A, Mangum J H, Pappas T N, Harpole D H et
al. Reducing hospital morbidity and mortality following esophagectomy. Ann
Thorac Surg 2004; 78: 1170-1176.
-
Avendano CE, Flume PA, Silvestri GA, King LB, Reed CE. Pulmonary
complications after esophagectomy. Ann Thorac Surg 2002; 73: 922-926.
-
Álvarez Lerma F. Complicaciones infecciosas en
el postoperatorio de cirugía abdominal.
Madrid: Ediciones Ergon, 2000:
27-30.
-
Jaber S, Delay JM, Chanques G, Sebbane M, Jacquet E,
Souche B et al. Outcomes of patients with acute respiratory failure after
abdominal surgery treated with noninvasive positive pressure ventilation.
Chest 2005; 128: 2688-2695.
-
Michelet P, D´Journo XB, Roch A,
Papazian L, Ragni J, Thomas P et al.
Perioperative risk factors for
anastomotic leakage after esophagectomy. Chest 2005; 128: 3461-3466.
-
ARDS Network.Ventilation
with lower tidal volumes as compared with traditional tidal volumes for
acute lung injury and the acute respiratory distress syndrome. N Engl J
Med 2000; 342: 1301-1308.
-
Abunasra H, Lewis S, Beggs L,
Duffy J, Beggs D, Morgan E. Predictors of operative death after
oesophagectomy for carcinoma. Br J Surg 2005; 92: 1029-1033.
-
Guidelines for the management
of adults with hospital-acquired, ventilator-associated, and
healthcare-associated pneumonia. Am
J Resp Crit Care Med 2005; 171: 388-416.
-
Collard HR, Saint S, Matthay MA.
Prevention of ventilador-associated pneumonia: An evidence-based
systematic review. Ann Intern Med 2003;
138: 494-501.
-
Bernard GR, Artigas A, Brigham KL
et al. “The American-European Consensus Conference on ARDS: definitions,
mechanisms, relevant outcomes and clinical trial coordination”. Am J
Respir Crit Care Med 1994; 149: 818-824.
-
Mair
DC, Hirschler N, Eastlund T. Blood donor and component management
strategies to prevent transfusion-related acute lung injury (TRALI). Crit
Care Med 2006; 34: S137-S143.
-
Gajic O, Gropper MA, Hubmayr RD.
Pulmonary edema after transfusion: how to differentiate
transfusion-associated circulatory overload from transfusion-related acute
lung injury.
Crit Care Med 2006; 34: S109-S113.
Lara Marqués Álvarez, Francisco Taboada Costa
Medicina Intensiva, Hospital Universitario Central de Asturias, Oviedo
©REMI, http://remi.uninet.edu.
Noviembre
2006.
Palabras clave: Postoperatorio de esofaguectomía,
Complicaciones respiratorias postoperatorias.
Envía tu comentario para su
publicación |