|
| |
|
Revista
Electrónica de Medicina Intensiva
Artículo nº C22. Vol 5 nº 1, enero 2005.
Autor: Jose Ángel Sánchez-Izquierdo Riera
|
[ Anterior ] [ Arriba ] [ Siguiente ]
|
|
En
capítulos anteriores del curso hemos visto cómo la sepsis y el shock
séptico cursan con una gran disminución de la resistencia vascular
sistémica y con una anómala distribución del flujo sanguíneo. El volumen
intravascular efectivo está reducido en estos pacientes, conduciendo a la
inestabilidad hemodinámica típica. Hemos visto también que aunque el gasto
cardiaco está aumentado en la sepsis, el flujo no está distribuido
uniformemente en los diversos lechos vasculares. Existe una reducción del
flujo en el músculo miocárdico y esquelético y, sobre todo, en el lecho
esplácnico. Este hecho condiciona que, en muchos casos, aparezca un
deterioro de la función renal en este contexto.
El shock
séptico requiere una reposición de volumen rápida y vigorosa. Ya el
estudio de Rivers y colaboradores [1] demostró cómo un tratamiento
agresivo de los pacientes durante las primeras seis horas de evolución,
antes incluso del ingreso en medicina intensiva, condicionaba una mayor
supervivencia de los pacientes. La diuresis, como expresión final de
correlación entre perfusión y funcionalismo renal, está presente en todos
los índices precoces de valoración del estado hemodinámico en la sepsis y
en todos los objetivos terapéuticos. En este contexto, la oliguria es un
índice clásico de hipoperfusión global y conseguir una diuresis superior a
0,5 mL/kg/h es uno de los objetivos terapéuticos recomendados en este
trabajo [1].
Desgraciadamente, al igual que con la dopamina, múltiples fármacos y
terapéuticas encaminadas a la “protección” renal en la sepsis han
fracasado [2]. Por ello, si los objetivos de mejoría global de la
perfusión tisular no se consiguen precozmente, la función renal suele
deteriorarse en el contexto de la sepsis grave.
Aunque detectar el
fracaso renal agudo (FRA), especialmente en sus estadios más precoces, es
problemático [3]; debemos asumir que el FRA es un problema común en
pacientes sépticos. En el estudio que realizó el grupo de trabajo de
cuidados intensivos nefrológicos de la SEMICYUC, en que participaron 41
servicios de medicina intensiva del país [4], la incidencia de FRA fue del
5,6%. Esta incidencia se elevó al 8,6% cuando no se consideraron los
pacientes coronarios, con incidencia significativamente menor (1%).
Además, este fracaso suele producirse en el seno del síndrome de
disfunción multiorgánica (SDMO), con el consiguiente aumento en la
mortalidad de los pacientes. En este mismo estudio el 93% de
los FRA se acompañaron de uno o más fallos orgánicos. Además la rapidez
del deterioro no permite la respuesta adaptativa.
El manejo del FRA
del paciente crítico es uno de los aspectos que más ha evolucionado en los
últimos 25 años. El objetivo del tratamiento es diferente al del paciente
con insuficiencia renal crónica, en el que se intenta retrasar al máximo
el inicio de la depuración extracorpórea. En el paciente con FRA,
intentamos minimizar las complicaciones “metabólicas” que pueden afectar
negativamente la evolución de nuestros pacientes; por ello, en este
contexto clínico no son directamente aplicables los criterios de
“dosificación” de la depuración extrarrenal del paciente crónico.
Preferiremos hablar, pues, de “soporte renal”, frente al concepto más
simple de “depuración renal”.
En este capítulo del curso
vamos a centrarnos en el papel de las técnicas continuas de depuración
extracorpórea (TCDE) en la sepsis, diferenciando el papel que deben
realizar en el soporte renal de este tipo de pacientes (utilidad
claramente establecida) del papel “potencial” de soporte en el contexto de
la disfunción multiorgánica con o sin FRA.
|
2. Características
de las TCDE |
Las
técnicas continuas de depuración extracorpórea han ocupado en los últimos
años un puesto importante en la depuración renal en las unidades de
medicina intensiva (UCIs). En el estudio
epidemiológico español antes mencionado [4], el 38% de los FRA recibieron
tratamientos de depuración extracorpórea. De éstos el 84% fueron TCDE.
Este predominio se basa una serie de características que implican ventajas
de las TCDE frente a la hemodiálisis intermitente (HDI) en pacientes
críticos [5]:
la principal es la mayor estabilidad hemodinámica que se logra con su uso;
que permite su utilización en pacientes inestables, en los que la HDI es
muy difícil de realizar. La TCDE es un tratamiento lento y continuado que
evita los bruscos cambios en la volemia y en las concentraciones de
electrolitos que se producen con la técnica convencional. La eliminación
gradual y continua de agua y metabolitos tóxicos permite una gran
flexibilidad en el manejo hidroelectrolítico, generando "espacio" para la
administración de nutrición artificial completa y medicación intravenosa
[5]. Además, puede generar una mejoría en el intercambio gaseoso por
disminución de la presión hidrostática y por mejora de las presiones de
llenado ventricular [6].
Otra
ventaja de las técnicas continuas es el control metabólico que conllevan,
evitando los niveles elevados de urea, con eliminación brusca, que se
aprecian con la HDI. Con la utilización juiciosa de los fluidos de
reposición, la concentración de electrolitos se puede aumentar o disminuir
de forma gradual, independientemente de los cambios en el volumen corporal
total de agua [7].
Otras
ventajas potenciales incluyen un bajo volumen sanguíneo extracorpóreo,
menor activación del complemento (en base al uso de membranas más
biocompatibles), eliminación preferente de líquido del espacio
intersticial, y tasa de complicaciones muy escasa [8]. Todo ello, unido al
hecho de que las TCDE en sus diversas modalidades permiten el control de
la uremia y el volumen intravascular sin restricción de la ingesta
proteica ni de líquidos; así como que no requieren de personal
especializado en técnicas de diálisis, las han convertido en unas técnicas
ampliamente utilizadas en las UCIs [8, 9].
2.1 Efectos
no renales
Ya en la
década de los 80, varios autores [10-13] comienzan a detectar efectos
beneficiosos de las TCDE que superan a los de ser una buena técnica de
depuración renal en pacientes críticos. Algunos datos sugieren que las
TCDE pueden influir favorablemente en el curso clínico y, posiblemente, en
la evolución de este tipo de pacientes, incluso en ausencia de fracaso
renal.
Debido a
que las TCDE permiten el aporte de nutrientes sin restricción de volumen,
pueden suprimir el efecto de la malnutrición sobre la mortalidad de los
pacientes críticos [8]. La acidosis láctica, frecuente en este tipo de
enfermos, tiene un efecto adverso demostrado sobre la hemodinámica de los
mismos. Datos experimentales sugieren que la hiperlactacidemia,
independientemente de la acidosis, también ejerce efectos adversos sobre
el sistema cardiovascular. Además, la acidosis influye significativamente
sobre el estado catabólico de los pacientes con fracaso renal. La
corrección de la acidosis con TCDE puede ser beneficiosa en el contexto
del paciente crítico [14]. La eliminación neta de fluidos con la técnica,
en pacientes hipervolémicos, puede mejorar el rendimiento cardiaco al
inducir cambios en la precarga, conduciendo a un punto más adecuado en la
curva de Starling [6]. Además, el balance hídrico negativo puede tener su
influencia beneficiosa sobre el edema pulmonar intersticial y la presión
hidrostática en la circulación pulmonar, incluso en pacientes con SDRA,
mejorando el intercambio gaseoso [11, 12].
Un
beneficio potencial adicional [15] se relaciona con el aclaramiento de
sustancias circulantes de peso molecular medio-alto (0,5-50 KD) como los
mediadores de inflamación (citoquinas, eicosanoides, anafilotoxinas,
etc.), involucrados en la patogénesis del síndrome de distrés respiratorio
agudo (SDRA) y el síndrome de disfunción multiorgánica (SDMO).
Estudios
retrospectivos y no controlados han demostrado un beneficio en la
hemodinámica y el intercambio gaseoso tras la instauración de la TCDE en
varias situaciones clínicas, tales como shock cardiogénico refractario,
shock séptico, SDRA y SDMO [10-13]. Beneficio que no podía ser explicado,
o lo hacía sólo en parte, por el impacto de la técnica sobre el balance
hídrico.
Se ha
demostrado la eliminación de varios mediadores inflamatorios con las TCDE,
incluyendo el TNF-alfa y el "factor depresor miocárdico" [15]. En modelos
animales de shock séptico [16-18], la hemofiltración isovolémica mejoraba
la hemodinámica, el intercambio gaseoso y el tiempo de supervivencia. El
aclaramiento convectivo de varios mediadores fue demostrado. Además, la
infusión de ultrafiltrado de animales sépticos sobre animales sanos
provocaba un deterioro hemodinámico y respiratorio similar al observado en
modelos de shock séptico.
La
experiencia inicial de nuestro grupo con las TCDE [9, 19] fue coherente
con la evidencia anteriormente referida; con una tolerancia hemodinámica
buena en los pacientes, a pesar de que la mayoría de los mismos estaban
con infusión de fármacos vasoactivos. Se pudo incluso, en muchos casos,
reducir la dosis de fármacos vasoactivos prefundidos. Utilizamos la
depuración extrarrenal ante diversas situaciones patológicas: fracaso
renal agudo, aislado o en el seno del SDMO; situación de disfunción
multiorgánica o SDRA evolucionados, sin fracaso renal; tratamiento de
hipotermia accidental; y SDMO incipiente. Apreciamos una diferencia
significativa de mortalidad según la indicación de la TCDE (tabla I).
|
Tabla I: Mortalidad encontrada en
pacientes sometidos a TCDE en relación a su indicación
|
| |
| Indicación HFVVC |
Nº pacientes |
Mortalidad |
| FMO con FRA |
31 (48,4%) |
31 (100%) |
| FMO sin FRA |
14 (21,9%) |
7 (50%) |
| SDRA |
3 (4,7%) |
1 (33,3%) |
| Indicación precoz |
11 (17,2%) |
2 (18,2%) |
| FRA |
4 (6,2%) |
0 (0%) |
| Hipotermia |
1 (1,6%) |
0 (0%) |
Total: |
64 |
41 (64%) |
| |
|
|
|
HFVVC: Hemofiltración venovenosa continua. FMO: fracaso multiorgánico. FRA:
fracaso renal agudo. SDRA: síndrome de distrés respiratorio agudo. |
La
mortalidad en el grupo del SDMO con fracaso renal era superior a la de
cualquier otro grupo (p<0,001). Sin considerar esta indicación, no
apreciamos diferencias evolutivas entre el resto de grupos de indicación.
La mortalidad fue nula en situaciones menos críticas (fracaso renal sin
SDMO [4 casos] y recalentamiento activo de una hipotermia grave), lo que
confirma la buena tolerancia de la técnica en sí misma. Las complicaciones
fueron escasas y poco graves.
|
3. Utilidad
en el manejo del fracaso renal agudo |
Existen
múltiples trabajos que apoyan la utilidad de la técnica en el fracaso
renal agudo; incluso en pacientes altamente catabólicos como los sépticos
[5, 9, 15, 20]. Aunque la alta capacidad de eliminación de fluidos con
estas técnicas no se cuestiona (el balance hídrico obtenido se puede
adaptar a la situación de cada paciente y a cada momento evolutivo), está
menos definido el aclaramiento de solutos necesario para conseguir el
mejor control metabólico del paciente. Algunos trabajos que han iniciado
profilácticamente el tratamiento dialítico, sugieren que mantener las
cifras de nitrógeno ureico por debajo de 100-120 mgr/dL mejora la
supervivencia en el fracaso renal agudo [5, 21]. En esta misma línea, un
trabajo que comparaba dos técnicas continuas (espontánea y con bomba),
demostró una mejor supervivencia al aumentar el aclaramiento de urea desde
7,5 hasta 15 litros al día [8]. Parece, pues, que el objetivo terapéutico
debería estar en conseguir los aclaramientos antes mencionados, fácilmente
obtenibles con la hemofiltración continua (especialmente con las técnicas
venovenosas con bomba).
Además,
existe evidencia de que el control metabólico obtenido con TCDE (venovenosa
o arteriovenosa con diafiltración) es superior al obtenido con
hemodiálisis convencional, por el efecto rebote en la concentración de
solutos que se produce con las técnicas intermitentes [5, 7, 8].
Las TCDE
presentan varias ventajas cuando se comparan con tratamientos de
depuración convencionales, y generalmente se consideran las técnicas de
elección para el tratamiento del FRA en pacientes críticos [21, 22]. Sin
embargo, aunque facilitan mucho el manejo de estos pacientes, no se ha
demostrado claramente si estas técnicas mejoran la supervivencia.
Se han
publicado muchos estudios que valoran alguna de las técnicas continuas;
éstos muestran una amplia variedad de porcentajes de supervivencia
(40-80%), que pueden explicarse en parte por la diferencia de los
pacientes analizados (patología y nivel de gravedad).
Varios
estudios recientes han comparado la evolución de pacientes con FRA
tratados con hemodiálisis intermitente o con TCDE [23, 24]. La mayoría de
los estudios encuentran una tendencia hacia una mejor evolución de los
pacientes tratados con alguna de las técnicas continuas; y ninguno de
ellos ha mostrado una tendencia positiva a favor de las técnicas
intermitentes. La mejoría evolutiva en los pacientes tratados con TCDE
parece sugerirse por el hallazgo de supervivencias similares a la de los
pacientes tratados con HDI, a pesar de tratarse de pacientes más graves
(mayor puntuación APACHE-II y mayor número de fracasos orgánicos). La
mayor parte de estudios, retrospectivos, comparaban pacientes tratados con
TCDE frente a controles históricos, tratados con HDI. Por lo tanto, otros
factores diferentes al mero uso de técnicas continuas han podido influir
en el descenso en la mortalidad observado (mejor tratamiento integral,
nuevos fármacos, mejoría nutricional, etc). Por otro lado, en todos estos
estudios existe un claro sesgo en contra de las técnicas continuas; ya que
muchos pacientes seleccionados para recibir técnicas intermitentes no
podían completar el estudio por grave inestabilidad hemodinámica.
De los estudios
prospectivos y aleatorizados realizados hasta la fecha, el estudio de Mehta
[25] presenta graves problemas metodológicos que impiden obtener
conclusiones adecuadas: primero la aleatorización fracasó en la
distribución de los grupos, ya que los pacientes asignados al grupo de
hemofiltración continua presentaban mayor gravedad (de acuerdo a sus
valores de APACHE II y III); segundo, existe una limitación seria del
poder estadístico del mismo ya que se atribuyó una mortalidad del 70% para
el grupo control de diálisis intermitente, cuando la mortalidad real se
situó en el 40-50%; tercero, los pacientes con tensión arterial media (TAM)
inferior a 70 mmHg fueron excluidos del estudio (población que más se
podría haber beneficiado del uso de una TCDE); cuarto, se permitía el
cruzamiento de pacientes. A pesar de todo, el grupo de pacientes sometido
a TCDE que sobrevivió presentó una mejoría evolutiva en su función renal
(92,3% frente a 59,4%; p<0,01). El otro estudio aleatorizado de un cierto volumen
de pacientes (100 pacientes) [26], encontró un descenso del 15% en la
mortalidad del grupo sometido a TCDE (no significativo). Algunos pacientes
del grupo de diálisis intermitente tuvieron que ser excluidos del análisis
por inestabilidad hemodinámica grave. Si se hubieran incluido, la
disminución de la mortalidad en el grupo de TCDE habría ascendido hasta
más del 20%. En un reciente metaanálisis publicado [27] con todos los
estudios realizados hasta el momento (13 estudios, con 1.400 pacientes) se
encuentra que cuando se comparan pacientes con similar nivel de gravedad,
la disminución de la mortalidad hospitalaria con las técnicas continuas es
claramente significativa (p<0,01). Además de ello, en estos estudios se
demuestra que la recuperación del FRA es significativamente mejor y más
rápida cuando se utilizan las técnicas continuas.
En cuanto a los
criterios de “dosificación” de la depuración extrarrenal, inicio y
retirada de la misma, varios estudios “clásicos” parecían orientar hacia
la idea de que una mayor cantidad de tratamiento dialítico condicionaba
una mayor supervivencia [28]. Existen algunos trabajos recientes que
arrojan alguna luz al respecto.
Parece que una
mayor cantidad de depuración se correlaciona con una mejoría pronóstica.
En este sentido, el reciente trabajo prospectivo y aleatorizado de Ronco y
col. [29] demuestra en un grupo de 425 pacientes críticos con FRA
que, al menos cuando usamos membranas de polisulfona, el volumen de
hemofiltrado horario debe ser superior a 35 mL/Kg, consiguiendo un
descenso significativo en la mortalidad de estos pacientes (p<0,0007) a
los 15 días de haber suspendido la TCDE. El análisis se hizo por intención
de tratar, y compararon 3 volúmenes de hemofiltración horaria: 20, 35 y
45 mL/Kg. La diferencia de mortalidad se encuentra entre el primero de los
grupos y los dos restantes; aunque en el grupo de pacientes sépticos, la
dosis que conlleva una menor mortalidad es la de 45 mL/Kg (análisis
posterior). Otros autores, con diferente metodología de trabajo, no han
obtenido las mismas conclusiones [30].
Este principio
también debe extenderse al uso de técnicas intermitentes. El grupo de
Schiff y col. ha demostrado una mejor supervivencia y
recuperación del FRA cuando la diálisis convencional se realiza de forma
diaria, frente a la cadencia alterna clásica [31]. Estos autores realizan
un estudio prospectivo de asignación no aleatorizada (aunque alternante)
sobre 146 pacientes críticos con FRA, a los que someten alternativamente a
un tratamiento de HDI a días alternos frente a una HDI diaria. El objetivo
primario fue valorar la supervivencia a los 14 días de la última sesión de
HD. Existió un cierto enmascaramiento hasta el final de la primera sesión
de HDI. La distribución entre grupos fue homogénea, aunque la gravedad de
los mismos no parecía excesiva. La duración y eficacia de cada sesión de
HDI fue similar entre grupos. La HDI diaria provocó menos episodios de
hipotensión arterial, y condujo a un mejor control de la uremia, y a una
resolución más rápida del FRA (9 ± 2 vs 16 ± 6 días; p=0,001). La
mortalidad, en base al análisis de la intención de tratar, fue del 28%
frente al 46% en el grupo de HDI a días alternos (p=0,01). Asimismo, la HDI
diaria condicionó un menor desarrollo de síndrome de respuesta
inflamatoria sistémica (SRIS) y sepsis, insuficiencia
respiratoria y sangrado gastrointestinal; así como menor progresión del FRA
de no oligúrico a oligúrico.
La idea de hacer
más “continuas” las técnicas intermitentes ha llevado a algunos grupos a
idear la técnica SLEDD (“Slow low-efficient daily dialysis”) que podría
tener utilidad en algunos contextos. Consiste básicamente en una HDI
llevada a cabo con bajo flujo sanguíneo y de líquido de diálisis, durante
más tiempo (6-12 horas diarias) [32]. Esta técnica ofrece mayor
estabilidad hemodinámica, mejor corrección de la hipervolemia y un control
metabólico más adecuado que las técnicas intermitentes clásicas.
Del mismo modo, un
inicio más precoz de la TCDE en el seno del episodio de FRA parece
conllevar una mejoría pronóstica. Aquí destacamos el estudio de Gettings [33], que demuestra, en un grupo de 100 pacientes traumatizados con FRA,
que el inicio de la depuración con niveles de urea inferiores a 60 mgr/dL
mejora la supervivencia de estos pacientes, que presentaban un
similar nivel de gravedad (puntuación de ISS, puntuación en la escala de
Glasgow de nivel de conciencia, incidencia de shock en el momento del ingreso, etc.) y
de aclaramiento de creatinina antes de introducir la TCDE. La introducción
de la hemofiltración en fases más precoces de enfermedad (niveles menores
de BUN) implica una mejoría pronóstica (supervivencia del 80% en el grupo
de introducción precoz y del 61% en el de introducción tardía, p=0,04).
Otros autores también han encontrado una mejor evolución en el grupo de
pacientes con inicio más precoz de la depuración extracorpórea; así como
mayor mortalidad en el grupo de pacientes tratados con diuréticos en este
contexto, para controlar la oliguria inicial [9, 29].
|
4. Utilidad
en el manejo del
síndrome de disfunción multiorgánica |
Como
comentábamos al principio del capítulo, la utilidad potencial de las TCDE
en el seno del SDMO comenzó a evidenciarse desde el inicio de la
generalización de su uso en pacientes críticos. Barzilay y col. [10]
analizan cuatro grupos de pacientes con SDMO debido a sepsis. Los del
grupo 1 (n=8) recibieron terapia convencional, el grupo 2 (n=14) fue
tratado con hemofiltración arteriovenosa continua, el tercero (n=6) con
hemodiafiltración arteriovenosa continua, y el cuarto (n=11) con
plasmaféresis añadida a la hemodiafiltración. Encuentran un descenso
estadísticamente significativo en la mortalidad desde el 87% del grupo 1
hasta el 71% en el segundo, 50% en el tercero y 36% en el cuarto. El
estudio es retrospectivo y en el artículo no se encuentran suficientes
datos de comparación entre los diferentes grupos de tratamiento. Coraim y
col. [11], en un grupo de pacientes que tras cirugía cardiaca
desarrollaron "síndrome postreperfusión", encontraron una mortalidad del
33% comparada con un 68% en un grupo control; aunque el estudio presenta
problemas metodológicos serios y el grupo control, aunque vagamente
definido, presenta mayor gravedad que el grupo de estudio. Encontraron
además un aumento del gasto cardiaco, de la presión arterial media y de la resistencia vascular sistémica
(RVS), con descenso de la resistencia vascular pulmonar (RVP). Estos
autores también encontraron un descenso en los niveles de lactato
sanguíneos. Sin embargo, la observación más interesante fue la disminución
de los niveles del factor depresor miocárdico, que descendió en su estudio
desde 70±16 unidades hasta 33±1. Estos investigadores concluyeron que la
eliminación de mediadores tóxicos con la hemofiltración disminuía el
deterioro orgánico y mejoraba la mortalidad. Cosentino y col. [13],
realizan un estudio aleatorizado sobre 15 pacientes con SDRA, a 9 de los
cuales someten a hemofiltración continua. Encuentran una reducción de la
mortalidad en el grupo hemofiltrado desde el 83% hasta el 44%; aunque el
escaso número de pacientes y la falta de información en el artículo acerca
de los criterios de aleatorización y nivel de gravedad de los dos grupos hacen difícil extraer conclusiones. Gotloib y col.
[12]
encuentran una mejoría en los parámetros hemodinámicos analizados en un
reducido grupo de pacientes con SDRA secundario
a sepsis grave. Garzia y col. [34] encontraron aumento del gasto cardiaco
con disminución de RVS, RVP y presión arterial media, aunque en el estudio se realizaron
intentos (volumen y soporte inotrópico) para optimizar la situación
hemodinámica hasta alcanzar "un estado de consumo de oxígeno no
dependiente del flujo", hechos que podrían haber influido en los
resultados encontrados de presiones y resistencias. Sander y col. [35]
realizan un estudio aleatorizado sobre 28 pacientes que habían sufrido
cirugía abdominal mayor, con criterios de SRIS, a los que someten a
hemofiltración continua durante 48 horas. Encuentran una mejoría
hemodinámica clara, con disminución de la mortalidad desde el 31% en el
grupo control, hasta el 8% en el tratado. También encuentran una
eliminación marcada de TNF e IL-6, aunque no encuentran disminución de sus
niveles séricos, frente al grupo control. Riegel y col. [36], en
otro estudio controlado sobre 24 traumatizados graves (ISS superior a 27
puntos) con SRIS, encuentran un aumento significativo de la tensión
arterial media, la RVS y
la extracción tisular de oxígeno.
Nuestro
grupo realizó un estudio prospectivo, controlado y aleatorizado en un grupo de
pacientes politraumatizados graves en situación de disfunción
multiorgánica "incipiente" y sin fracaso renal [37]. Analizamos prospectivamente el efecto específico de la HFVVC en la hemodinámica y la
función respiratoria de estos pacientes, prolongando el periodo de
valoración hasta las 48 horas. La HFVVC mejoró
significativamente la tensión arterial media (p=0,0001) (Figura 1) y las RVS (p=0,0003) (Figura 2), sin cambios en la presión venosa central (PVC)
ni en la presión capilar pulmonar (PCP). El gasto cardiaco tampoco cambió
durante el estudio.
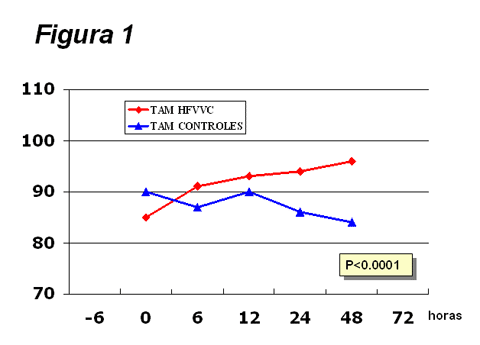
Figura
1.
Evolución de la tensión arterial media (PAM) en los pacientes estudiados. Encontramos una mejoría significativa (varianza de
medidas repetidas) en el grupo tratado con hemofiltración (HFVVC).
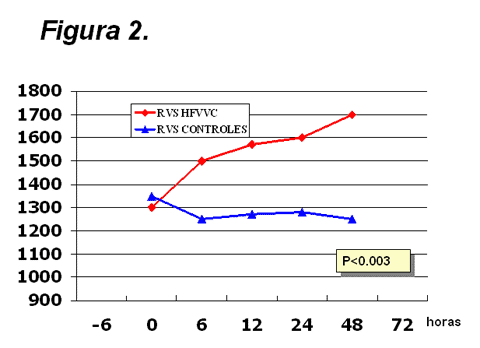
Figura
2.
Resistencia vascular sistémica (RVS) en los pacientes tratados con
hemofiltración (HFVVC) y en los controles. Este parámetro mejoró significativamente (varianza
de medidas repetidas) en el grupo de HFVVC.
Al analizar los parámetros respiratorios y de
transporte de oxígeno, confirmamos las experiencias de otros autores, con
mejoría clara de la oxigenación y la ventilación en los pacientes hemofiltrados (Figuras 3 y 4). Apreciamos asimismo un aumento
significativo de la extracción periférica de oxígeno. Este hecho podría
reflejar una mejoría en el flujo sanguíneo, con una mejor redistribución a
nivel periférico, hasta células previamente hipóxicas.
En
nuestro estudio, además, obtuvimos un descenso relativo de la mortalidad
del 15% en el grupo sometido a hemofiltración continua.
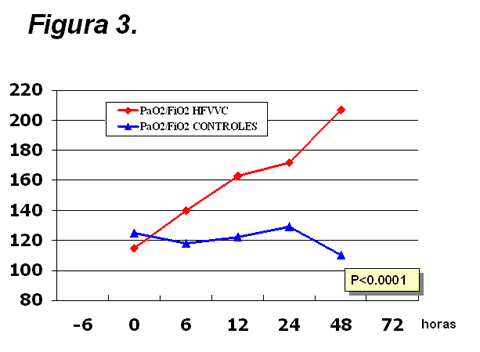
Figura
3.
Evolución del cociente PaO2/FiO2 en los pacientes tratados con
hemofiltración (HFVVC) y en los controles. Este parámetro mejoró significativamente (varianza
de medidas repetidas) en el grupo de HFVVC.
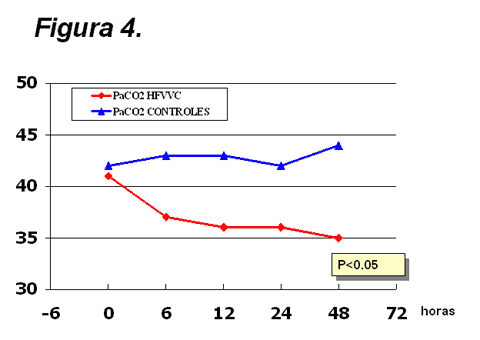
Figura
4.
Evolución de la paCO2 en los pacientes tratados con hemofiltración (HFVVC)
y en los controles. Este parámetro disminuyó significativamente
(varianza de medidas repetidas) en el grupo de HFVVC, sin que se
introdujeran cambios en los parámetros ventilatorios.
Más recientemente, otros autores
[38] valoran (en un estudio prospectivo de
cohortes) si la TCDE intermitente de alto volumen tiene algún impacto
sobre la mortalidad. Analizan los resultados obtenidos sobre 306 pacientes
graves (52% oligúricos), a los que someten precozmente (en las primeras 48
horas tras el ingreso) a sesiones intermitentes de HFVVC de alto flujo
(3.780 ml/h de media), que consiguen recambios globales de 100 litros de
fluidos. Encuentran una mortalidad significativamente menor a la prevista
en base al APACHE II, SAPS II e índice de Liaño en todos los grupos
pronósticos. Honoré y col. (39), en un grupo de 20 pacientes con
fracaso circulatorio grave secundario a shock séptico que no respondía a
tratamiento convencional de último escalón, valoran la respuesta a un
ciclo de hemofiltración de alto volumen (35 litros en 4 horas), seguido
de 4 días al menos de hemofiltración convencional (1 litro a la hora de
ultrafiltrado). Analizan mortalidad el 28º día, así como la respuesta
hemodinámica y metabólica a dicho tratamiento. Definen un grupo de 11
pacientes como “respondedores”, en base a la respuesta del índice
cardiaco, la evolución positiva de la acidemia, y el descenso en los
requerimientos de fármacos vasoactivos. La mortalidad en este grupo es del
18%. La mortalidad global es inferior a la prevista (p<0,05) en base a
APACHE II, nivel de lactato en sangre, y número de fracaso de órganos.
Observan que el grupo de “respondedores” es sometido a la TCDE de forma
más precoz, y el volumen de ultrafiltrado por kilogramo de peso es
significativamente superior al del grupo de “no respondedores”.
En otro
estudio reciente [40] en el que se analiza la evolución hemodinámica y la
de varios mediadores inflamatorios, cuando a un grupo de pacientes con shock séptico y SDMO se les somete de forma
aleatorizada y alterna a un
ciclo corto (8 horas) de una hemofiltración de alto volumen (6 litros a la
hora) o a un ciclo de 8 horas de hemofiltración convencional (1
litro/hora), encuentran que ambas técnicas mejoran de forma significativa
la hemodinámica de estos pacientes (disminución de la dosis de
noradrenalina necesaria para mantener la presión arterial media por encima
de 70 mmHg) y disminuye la concentración de varios mediadores
inflamatorios analizados. La técnica de alto volumen acentúa los efectos
beneficiosos encontrados. Otros autores [41] han encontrado resultados
similares, con tendencia hacia una mejoría evolutiva en el contexto del
paciente con shock séptico.
Dadas
nuestras experiencias con la HFVVC en el SDMO postraumático, decidimos
poner en marcha un estudio prospectivo de cohortes donde evaluamos la
supervivencia de pacientes politraumatizados graves con SDMO incipiente y
sin fracaso renal, en los que se introdujo una HFVVC. Desde enero del año
2000, consideramos candidato a HFVVC a todo paciente traumatizado grave
(consideramos como tal todo paciente con puntuación ISS al ingreso
superior a 25 puntos) que desarrolla SDMO (puntuación en la escala SOFA
superior a 6 puntos, sin considerar puntuación neurológica, por las
dificultades de valoración en pacientes bajo sedoanalgesia) y sin fracaso
renal agudo (puntuación SOFA renal de cero), que obligaría a instaurar la HFVVC por ese motivo. Consideramos incipiente al SDMO cuando la puntuación
SOFA se desarrolla tras 24 horas del trauma y antes de transcurridas 48
horas del mismo.
Los
pacientes que cumplen estos requisitos son sometidos, además del
tratamiento convencional, a un ciclo de HFVVC durante siete días. La
técnica se lleva a cabo con un protocolo uniforme, membrana de AN69 que se
cambia cada 24 horas como máximo, monitor Prisma (Hospal),
balance neutro con la técnica y volumen de efluente superior a 1 litro a
la hora.
En el
grupo de tratamiento valoramos la edad, la puntuación del Injury Severity
Score (ISS) [42] y del Trauma Score Revisado (TSR) [43]. Asimismo
consideramos el tiempo de estancia en UCI, las complicaciones en la
evolución (especialmente las relacionadas con la técnica empleada), y la
evolución de los pacientes (alta o exitus). Comparamos finalmente la
supervivencia “real” de los mismos con la supervivencia “esperada” en base
a metodología TRISS [44]. Esta metodología (con el uso de estadísticas Z y
M) estima la probabilidad de supervivencia individual de los pacientes
traumatizados en base a una fórmula que incluye unos coeficientes de
valoración derivados de análisis de regresión logística de Walker-Duncan y
aplicados en base a los datos obtenidos de los miles de pacientes
analizados en el “Major Trauma Outcome Study” (MTOS). La mortalidad
obtenida del MTOS cambia a lo largo del tiempo, por lo que estos
coeficientes también irán cambiando. La fórmula incluye los valores
obtenidos del ISS, TSR y la edad (con 55 años como edad de corte).
El ISS
(con sus actualizaciones periódicas) se considera como el índice anatómico
estándar para valorar la gravedad del trauma. Considera las peores
puntuaciones del AIS [42] de las tres regiones anatómicas más afectadas. El TSR es una escala fisiológica que valora 3 parámetros (GCS, TAS y
frecuencia respiratoria) para cuantificar la gravedad del trauma.
Con los
primeros 81 pacientes incluidos, observamos una edad media de 41 ± 12 años
(rango de 14 a 74). El ISS medio de 43 ± 10 puntos (rango 26 a 66). El TSR
pronóstico, de 5,65 ± 1,73 puntos (rango desde 0 a 7,8). La estancia media
de los pacientes fue de 25 ± 14 días. Cuando comparamos la supervivencia
real (86%) con la esperada en base a la metodología TRISS (59%),
encontramos un aumento en la supervivencia de los pacientes sometidos a
HFVVC (p<0,05); y esto a pesar del sesgo del estudio, que incluye sólo a
aquellos pacientes que desarrollan SDMO precoz (con mortalidad superior a
la estimada en la muestra general (Figura 5).
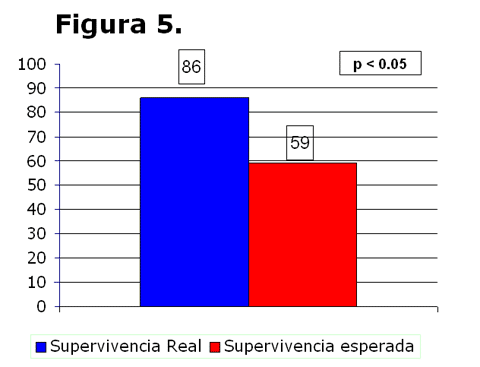
Figura
5.
Comparación entre la supervivencia encontrada en nuestra serie
(supervivencia real) y la supervivencia esperada en base a la metodología
TRISS. Encontramos una mortalidad significativamente inferior a la
esperada en el grupo de pacientes sometidos a HFVVC.
En este
contexto de valoración del beneficio evolutivo de las TCDE en la sepsis,
algunos autores están utilizando técnicas que potencian la adsorción de
moléculas frente a la eliminación convectiva [45-48]. Uno de los sistemas
con los que se está trabajando más recientemente consiste en separar el
plasma sanguíneo con un plasmafiltro y entonces regenerarlo, antes de
devolverlo al paciente, utilizando uno o varios cartuchos de resinas
sintéticas. Las experiencias iniciales en pacientes sépticos son muy
alentadoras.
Ante
estos hallazgos clínicos “evidentes”, se ha postulado sobre los mecanismos
básicos en los que se sustentan dichos hallazgos. Las hipótesis más
importantes se basan en dos mecanismos (posiblemente interrelacionados).
El primero de ellos sería una mejoría en la microcirculación debida a la
eliminación preferente de líquido intersticial (característica
“intrínseca” a estas técnicas); con una mejoría del juego de presiones a
nivel tisular. Este mecanismo podría explicar la mejoría respiratoria que
se evidencia con el uso de estas técnicas, e incluso la mejoría de la
microcirculación que parece reflejar el aumento en la extracción de
oxígeno que encuentran
muchos autores, pero no justificaría inicialmente la mejoría hemodinámica.
El segundo mecanismo, que es el que está promoviendo un mayor número de
experiencias en la literatura, sería el de la eliminación de mediadores
inflamatorios.
Usando una
variedad de modelos animales [16-18, 49] y estudios en humanos [49, 50],
muchos investigadores han intentado demostrar las posibles ventajas de las
técnicas continuas en la eliminación de mediadores inflamatorios. De los
datos disponibles se sabe que muchos mediadores pueden ser eliminados (TNFalfa,
IL-1, IL-6, IL-8, fracciones del complemento, etc.).
Se ha demostrado que las macromoléculas se eliminan mejor por convección
que por difusión. Consecuentemente, si el objetivo es eliminar sustancias
de alto peso molecular, entre las que se encuentran las citoquinas
proinflamatorias, se debe optimizar el mecanismo convectivo [49, 50].
Incluso se están buscando membranas con mayor capacidad de eliminación convectiva.
Además,
las características de la membrana usada para la HFVVC puede ser un factor
importante en el aclaramiento de citokinas [49]. El uso de diferentes
membranas puede conllevar un aclaramiento diferente de las mismas. Se ha
demostrado "in vitro" que la membrana de poliacrilonitrilo (PAN) es dos o
tres veces más efectiva que las de polisulfona o poliamida en el
aclaramiento de TNF. La transferencia de TNF con este tipo de membranas es
superior a la que aparece en el líquido ultrafiltrado, sugiriendo una
adsorción del mismo por parte de la membrana. Utilizando membranas de PAN
"in vivo", muchos autores han encontrado eliminación de TNF e
interleuquinas [16].
Un
problema con las membranas de depuración extracorpórea es su posible
capacidad para inducir producción de citokinas; hecho que podría ser
deletéreo en este contexto [49]. Los autores encontraron, utilizando un
modelo "in vitro" en el que se incubaba sangre con fragmentos calibrados
de membranas de cuprofán y PAN, que sólo la membrana de cuprofán provocaba
un aumento de los niveles de IL-1, IL-6 y TNF. No se observó tal efecto
con los fragmentos de PAN. Estos autores atribuyen esta elevación a una
activación de la cascada del complemento, tras el contacto con la membrana
de cuprofán. Hornych y col. [51] analizan en un grupo de
pacientes urémicos la posible inducción de la liberación de los leucotrienos B4 y C4, así como del tromboxano B2 con membranas de cuprofán
y PAN. La hemodiálisis con cuprofán inducía una leucopenia marcada precoz,
así como un incremento significativo de los eicosanoides determinados. Con
la membrana de PAN no se produjo tal efecto. Algunos autores, incluso,
encuentran mayor mortalidad y mayor incidencia de infecciones bacterianas
en el grupo de pacientes tratados con membranas de cuprofán, frente al
grupo tratado con membranas de PAN. Por otro lado, Salmon y col. [52] analizan la posible activación del sistema de contacto y la vía
intrínseca de la coagulación en pacientes bajo hemofiltración venovenosa
continua con membrana de PAN. Estos autores tampoco encuentran una
activación del sistema de contacto con el uso de esta membrana.
Existen
algunos estudios aleatorizados que analizan específicamente
este aspecto. Los estudios clásicos de Hakim y col. [53] y Schiffl y col.
[54] demuestran que el uso de la membrana de cuprofán (frente a la de
AN69) afecta negativamente a la supervivencia, la aparición de sepsis, la
duración de la oliguria y a la recuperación de la función renal de los
pacientes críticos sometidos a depuración extracorpórea. Himmelfarb y
col. [55] ampliaron el estudio clásico de Hakim, confirmando la
diferencia significativa en la supervivencia y la recuperación renal de
pacientes con fracaso renal agudo. Recientemente, sin embrago, los
estudios de Jörres [56], Gastaldello [57] y Albright [58] no encuentran
diferencias en la mortalidad y recuperación de la función renal con el uso
de membranas biocompatibles frente a incompatibles. Es importante señalar
que en el primero de los estudios mencionados se compara el uso de cuprofán con la membrana de PMMA (la más liberadora del complemento de las
consideradas compatibles), y los otros dos usan la membrana de diacetato
de celulosa como ejemplo de membrana bioincompatible. Si analizamos
conjuntamente todos los pacientes tratados con cuprofán frente a los
tratados con membranas sintéticas o de diacetato de celulosa, la
mortalidad es significativamente mayor en el grupo de cuprofán. Por ello,
no parece razonable el uso de cuprofán en la depuración renal del paciente
crítico con FRA.
Cuando
buscamos potenciar la eliminación de mediadores inflamatorios, las
diferencias basadas en el tipo de membrana utilizada son aún más acusadas.
Experimentos de hemofiltración con la membrana AN69 (poliacrilonitrilo en
gel) han demostrado una adsorción considerable de TNF e IL-1. Esta
capacidad adsortiva se satura con el tiempo. En el estudio de Van Bommel y
col. [24] con membranas de poliacrilonitrilo, el coeficiente de
aclaramiento del TNF aumentó significativamente (in vitro) tras 24 horas
de hemofiltración con la misma membrana (desde 0,01 ± 0,003 hasta 1,0 ± 0,01).
Algunos autores
actualmente utilizan tasas de filtración de 100 L/día, para aumentar el
aclaramiento de mediadores, en sus pacientes con disfunción multiorgánica.
Sin embargo, muchos asuntos prácticos quedan aún por resolver cuando se
utilizan tasas de hemofiltración tan elevadas, y ya existe evidencia [59]
de una eliminación significativa de vitaminas hidrosolubles con el uso de TCDE de alto volumen.
No debemos olvidar
la importante capacidad adsortiva de algunas membranas, capaces de
eliminar por esta vía importantes cantidades de citoquinas. Por ello,
otros autores entre los que me encuentro, propugnan unos volúmenes de UF
no tan elevados, con recambio frecuente de membranas. En el reciente
trabajo de Cole y col. [40], la evolución hemodinámica y de
varios mediadores inflamatorios analizados no es tan diferente entre una
técnica convencional (1 litro de ultrafiltrado a la hora) y una de alto
flujo (6 litros a la hora); utilizando por supuesto membranas de AN69.
Por otro lado,
aunque pueden encontrarse mediadores inflamatorios en el filtrado o
dializado de las técnicas continuas, estaría pendiente demostrar que esta
eliminación produzca un descenso significativo en sus niveles séricos o
que exista una mejoría clínica de la respuesta inflamatoria. En este
sentido, múltiples autores han confirmado la utilidad de las TCDE en la
eliminación “significativa” de varios mediadores inflamatorios:
Hofmann
y col. [60], en un estudio observacional sobre 16 pacientes a los que
someten a hemofiltración de 2 litros/hora, encuentran una importante
eliminación de algunos factores del complemento con la técnica aplicada,
tanto en el grupo de pacientes como en el de voluntarios sanos (con un
aumento significativo de la presión arterial media y las RVS). Estos resultados están en
concordancia con los de otros estudios en los que también se demostraba la
eliminación del factor C3a y el factor D con TCDE. Braun y col. [61], en un estudio
aleatorizado sobre 30 pacientes sépticos,
encuentran una disminución significativa de los niveles plasmáticos de TNF,
IL-6 y Complejo Terminal del Complemento (TCC) con el uso de
TCDE. Ronco [62] en un estudio de laboratorio sobre pacientes sanos,
encuentra eliminación del factor Activador Plaquetario (PAF), con descenso
de sus niveles plasmáticos. Heering y col. [63], en un estudio
controlado sobre 33 pacientes a los que someten a 72 de horas de hemofiltración continua, encuentran eliminación importante de varios
mediadores, con mejoría hemodinámica de los pacientes.
En
nuestro estudio controlado sobre pacientes traumatizados graves con SDMO
incipiente [50], valoramos la evolución de los niveles de algunas citokinas y eicosanoides (TNF, IL-6, TX-A2 y LK-B4) a través de su
eliminación por hemofiltración continua. Sin embargo, a pesar de una gran
eliminación de los 4 mediadores analizados, los niveles séricos de TNF,
IL-6 y LK-B4 no disminuyeron significativamente durante el período de
estudio. En nuestra experiencia, sólo los niveles del tromboxano-A2
disminuyen significativamente en el grupo sometido a hemofiltración
(Figura 6).
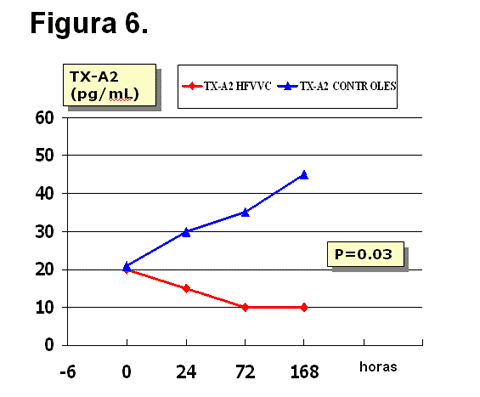
Figura
6.
Cambios en las concentraciones medias del tromboxano-A2 (TX-A2) durante el
período de estudio. Encontramos un descenso significativo (varianza de
medidas repetidas) del mismo en el grupo sometido a hemofiltración.
Esta evidencia de “modulación” del sistema inmunológico ha conducido a
postular la “teoría de los picos”, que se basa en el concepto de que estas
técnicas poseen la capacidad de eliminar sustancias tanto proinflamatorias
como antiinflamatorias de forma genérica y autorregulada, ya que eliminan
sustancias en relación a su concentración plasmática en cada momento. Este
hecho conduciría a una regeneración del sistema inmune y explicaría el
descenso de estos mediadores-marcadores inflamatorios “distales” a pesar
de una relativamente escasa eliminación absoluta porcentual de citoquinas
concretas.
Creemos que existe
suficiente evidencia científica que apoya la utilidad potencial de las
TCDE en el seno del shock séptico y de la disfunción multiorgánica de
otras etiologías: estas técnicas mejoran de forma clara la hemodinámica y
la situación respiratoria de los pacientes, así como parecen mejorar la
evolución de los mismos.
Es importante
señalar que son técnicas sencillas y seguras, con la formación y el
equipamiento adecuados, y que no existen en la literatura experiencias
negativas cuando se utilizan en este contexto clínico.
Estos beneficios
potenciales podrían deberse a una eliminación-modulación de la cascada
inflamatoria (eliminación convectiva y adsortiva), aunque no se pueden
descartar otras hipótesis (probablemente complementarias).
Es importante
señalar asimismo, que la interrelación paciente-membrana extracorpórea es
compleja, y que las diferentes membranas y las diferentes tecnologías de
depuración presentan resultados distintos, que deben ser valorados.
Esperemos que en
un futuro muy próximo podamos resolver definitivamente los enigmas que
persisten en este campo de la atención al paciente crítico.
-
Rivers E, Nguyen B, Havstad S, et al. Early Goal-Directed Therapy
Collaborative Group. Early goal-directed therapy in the treatment of
severe sepsis and septic shock. N Eng J Med 2001; 345: 1368-1377.
-
Lameire NH, De Vriese AS, Vanholder R. Prevention and nondialytic
treatment of acute renal failure. Curr Opin Crit Care 2003; 9:
481-490.
-
Bellomo R, Kellum JA, Ronco C. Defining acute renal failure: physiological
principles. Int Care Med 2004; 30: 33-37.
-
Maynar J,
Sánchez-Izquierdo JA, Daga D, Herrera M y Grupo de Trabajo de Cuidados Intensivos
Nefrológicos de la SEMICYUC. Situación Actual del reemplazo Renal en las
UMI de la SEMICYUC.
Medicina Intensiva
2001; 25S:112.
-
Van Bommel EFH, Ponssen HH. Intermittent versus continuous treatment for
acute renal failure: Where do we stand?. Am J Kidney Dis 1997; 30:
S72-S79.
-
Boulain T, Delpech M, Legras A, et al. Continuous venovenous
haemodiafiltration in acute renal failure associated with multiple organ
failure: influence on outcome. Clin Invest 1996; 7: 4-10.
-
Paganini EP, Tapolyai M, Goormastic, et al. Establishing a dialysis
therapy/patient outcome link in intensive care unit dialysis for patients
with acute renal failure. Am J Kidney Dis 1996; 28 (Suppl 3):
S81-S89.
-
Clark WR, Mueller BA, Alaka KJ, et al. A comparison of metabolic control
by continuous and intermittent therapies in acute renal failure.
J Am Soc Nephrol
1994; 4: 1413-1420.
-
Sanchez-Izquierdo
Riera JA, Lozano Quintana MJ, Ambros Checa A, et al. Hemofiltración
venovenosa continua en pacientes críticos. Medicina Intensiva
1995; 19: 171-176.
-
Barzilay E, Kessler D, Berlot G, Gullo A, Geber D, Ben Zeev I. Use of
extracorporeal supportive techniques as additional treatment for septic-induced
multiple organ failure patients.
Crit Care Med
1989; 17: 634-637.
-
Coraim F, Coraim HP, Ebermann R,
Stellwag FM. Acute respiratory failure after cardiac surgery: clinical
experience with the application of continuous arteriovenous hemofiltration. Crit Care Med 1986; 14: 714-718.
-
Gotloib L, Barzilay E, Shustak A, et al. Sequential hemofiltration in
nonoliguric high capillary permeability pulmonary edema of severe sepsis:
Preliminary report. Crit Care Med 1984; 12: 997-1000.
-
Cosentino F, Paganini E, Lockrem J, Stoller J, Wiedemann H. Continuous
arteriovenous hemofiltration in the adult respiratory distress syndrome. A
Randomized trial. Contrib Nephrol 1991; 93: 94-97.
-
Mariano F, Benzi L, Cecchetti P, et al. Efficacy of continuous venovenous
haemofiltration (CVVH) in the treatment of severe phenformin-induced
lactic acidosis. Nephrol Dial Transplant 1998; 13: 1012-1015.
-
Varios autores. Proceedings of the First International Conference on
Continuous Renal Replacement Therapy. Am J Kidney Dis 1996; 28:
S1-S129.
-
Rogiers P, Zhang H, Smail N, et al. Continuous venovenous hemofiltration
improves cardiac performance by mechanisms other than tumor necrosis
factor-alpha attenuation during endotoxic shock. Crit Care Med
1999; 27: 1848-1855.
-
Kline JA, Gordon BE, Williams C, et al. Large-pore hemodialysis in acute
endotoxin shock. Crit Care Med 1999; 27: 588-596.
-
Mink SN, Li X, Bose D, et al. Early but not delayed continuous
arteriovenous hemofiltration improves cardiovascular function in sepsis in
dogs. Int Care Med
1999; 25: 733-743.
-
Sánchez-Izquierdo Riera JA, Alted López E, Lozano Quintana MJ, Pérez Vela
JL, Caballero Cubedo R, Cobo Castellano P. Influencia de la hemofiltración
venovenosa continua sobre la hemodinámica de los pacientes críticos.
Nefrología; 16: 154-159. 1996.
-
López Ferré J, Raurich
Puigdevall JM, Jordá Marcos R, et al. Hemofiltración contínua. Experiencia
en 66 pacientes. Medicina Intensiva 1991; 15: 367-369.
-
Silvester W.
Outcome studies of continuous renal replacement therapy in the intensive
care. Kidney Int 1998; 53: S138-S141.
-
Varios autores. Proceedings of the Second International Conference on
Continuous Renal Replacement Therapy.
Am J Kidney Dis
1997; 28: S1-S116.
-
Bellomo R, Mansfield D, Rumble S, et al. A comparison of conventional
dialytic therapy and acute continuous hemodiafiltration in the management
of acute renal failure in the critically ill. Renal Failure 1993;
15: 595-602.
-
Van Bommel EFH, Bouvy ND, So KL, et al. Acute dialytic support for the
critically ill: Intermittent hemodialysis versus continuous arteriovenous
hemodiafiltration. Am J Nephrol 1995; 15: 192-200.
-
Mehta R, McDonald B, Gabbai F, et al. Continuous versus intermittent
dialysis for acute renal failure in the ICU: results from a randomized
multicenter trial. J Am Soc Nephrol 1996; 5: 1457-1462.
-
Silvester W. Outcome studies of continuous renal replacement therapy in
the intensive care. Kidney Int 1998; 53: S138-S141.
-
Kellum JA, Angus DC, Johnson JP, et al. Continuous versus intermittent
renal replacement therapy: a meta-analysis. Int Care Med 2002; 28:
29-37.
-
Stork
M, Hartl WH, Zimmerer E, Inthorn D. Comparison of pump driven and
spontaneous continuous haemofiltration in postoperative acute renal
failure. Lancet 1991; 337: 452-455.
-
Ronco C, Bellomo R, Homel P, et
al. Effects of different doses in continuous veno-venous haemofiltration
on outcomes of acute renal failure: a prospective randomised trial.
Lancet 2000; 356: 26-30.
-
Bouman CS, Oudemans-Van Straaten HM, Tijssen JG, et al.
Effects of early high-volume
continuous venovenous hemofiltration on survival and recovery of renal
function in intensive care patients with acute renal failure : a
prospective, randomized trial. Crit care Med 2002; 30: 2205-2211.
-
Schiffl H, Lang S, Fischer R. Daily hemodialysis and the outcome of acute
renal failure. New Eng J Med 2002; 346: 305-310.
-
Vanholder R, Van Biesen WIM, Lameire N. What is the renal replacement
method of first choice for intensive care patients? J Am Soc Nephrol 2001; 12: S40-S43.
-
Gettings LG, Reynolds HN, Scalea T. Outcome in post-traumatic acute renal
failure when continuous renal replacement therapy is applied early vs
late. Int Care Med 1999; 25: 805-813.
-
Garzia F, Todor R, Scalea Th. Continuous arteriovenous hemofiltration
countercurrent dialysis (CAVH-D) in acute respiratory failure (ARDS). J
Trauma 1991; 31: 1277-1285.
-
Sander A, Armbruster W, Sander B, et al. The influence of
continuous hemofiltration on cytokine elimination and the cardiovascular
stability in the early phase of sepsis.
Contrib Nephrol 1995; 116: 99-103.
-
Riegel W, Ziegenfuss T, Rose M, et al.
Influence of venovenous
hemofiltration on postraumatic inflammation and hemodynamics. Contrib
Nephrol 1995; 116: 56-61.
-
Sanchez-Izquierdo Riera JA, Alted López E, Lozano Quintana MJ, et
al.Influence of continuous hemofiltration on the hemodynamics of trauma
patients. Surgery 1997; 122: 902-908.
-
Oudemans-Van Straaten HM, Bosman RJ, van der Spoel JI, Zandstra DF.
Outcome of critically ill patients
treated with intermittent high-volume haemofiltration: a prospective
cohort analysis. Int Care Med 1999; 25: 814-821.
-
Honoré PM, Jamez J, Wauthier M, et al. Prospective evaluation of
short-term, high-volume isovolemic hemofiltration on the hemodynamic
course and outcome in patients with intractable circulatory failure
resulting from septic shock.
Crit Care Med
2000; 28: 3581-3587.
-
Cole L, Bellomo R, Journois D, et al.
High-volume haemofiltration in
human septic shock. Int Care Med 2001; 27: 978-986.
-
Joannes-Boyau O, Rapaport S, Bazin R, Fleureau C, Janvier G. Impact of
high volume hemofiltration on hemodynamic disturbance and outcome during
septic shock. ASAIO J 2004; 50: 102-109.
-
Baker
SP, O´Neill B, Haddon W, et al. The injury severity score: A method for
describing patients with multiple injuries and evaluating emergency care.
J
Trauma 1974; 14:
187-196.
-
Champion HR, Sacco WJ, Carnazzo AJ, et al.
Trauma
Score. Crit Care Med 1981; 9:672-676.
-
Boyd
CR, Tolson MA, Copes WS. Evaluating Trauma care: The TRISS method. J
Trauma 1987; 27: 370-378.
-
Opal
SM. Hemofiltration-absortion systems for the treatment of experimental
sepsis: is it posible to remove the evil humors responsable for septic
shock? Crit care Med 2000; 28: 1681-1682.
-
Tetta
C, Gianotti L, Cavaillon JM, et al. Coupled plasma filtration-adsortion in
a rabbit model of endotoxic shock. Crit Care Med 2000; 28:
1526-1533.
-
Formica M, Olivieri C, Livigni S, et al. Hemodynamic response to coupled
plasmafiltration-adsortion in human septic shock. Int Care Med
2003; 29: 703-708.
-
Brendolan A. Coupled plasma filtration adsortion: rationale, technical
development and early clinical experience. Contrib Nephrol 2004:
144: 376-386.
-
De Vriese AS, Vanholder RC, Pascual M, Lameire NH, Colardyn FA. Can
inflammatory cytokines be removed efficiently by continuous renal
replacement therapies? Intensive Care Med
1999; 25: 903-910.
-
Sánchez-Izquierdo
Riera JA, Pérez Vela JL, Lozano Quintana MJ, et al.
Cytokines
clearance during venovenous hemofiltration in the trauma patient. Am J
Kidney Dis 1997; 30:483-488.
-
Hornych A, Rémi P, Luong N, et al.
Biocompatibility of haemodialysis
membranes: Haemodialysis-related leukotriene B4 and C4 generation.
Nephron 1996; 74: 11-18.
-
Salmon J, Cardigan R, Mackie I, et al. Continuous venovenous
haemofiltration using polyacrylonitrile filters does not activate contact
system and intrinsic coagulation pathways. Int Care Med 1997; 23:
38-43.
-
Hakim RM, Wingard RL, Parker RA. Effect of the dialysis membrane in the
treatment of patients with acute renal failure. N Engl J Med 1994;
331: 1338-1342.
-
Schiffl H, Lang SM, König A, et al. Biocompatible membranes in acute renal
failure: prospective case-controlled study. Lancet 1994; 344:
570-572.
-
Himmelfarb J, Tolkoff Rubin N, Chandran P, et al. A multicenter comparison
of dialysis membranes in the treatment of acute renal failure requiring
dialysis. J Am Soc Nephrol 1998; 9: 257-266.
-
Jörres
A, Gahl GM, Dobis C, et al. Haemodialysis-membrane biocompatibility and
mortality of patients with dialysis-dependent acute renal failure: a
prospective randomised multicentre trial. Lancet 1999; 354:
1337-1341.
-
Gastaldello K, Melot C, Kahn RJ, et al. Comparison of cellulose
diacetate and polisulfone membranes in the outcomes of acute renal
failure. A prospective randomised study. Nephrol Dial Transplant
2000; 15: 224-230.
-
Albright RC, Smelser JM, McCarthy JT, et al. Patient survival and
renal recovery in acute renal failure: randomised comparison of cellulose
acetate and polysulfone membrane dialysers. Mayo Clin Proc 2000;
75: 1141-1147.
-
Fortin
MC, Amyot SL, Geadah D, Leblanc M. Serum concentrations and clearances of
folic acid and pyridoxal-5´-phosphate during venovenous continuous renal
replacement therapy. Crit Care Med 1999; 25: 594-598.
-
Hoffman JN, Hartl WH, Deppisch et al.
Hemofiltration in human sepsis: evidence for elimination of
immunomodulatory substances. Kidney Int 1995; 48: 1563-1570.
-
Braun N, Rosenfeld S, Giolai M, et al. Effects of continuous
hemodiafiltration on IL-6, TNF-alfa, C3a, and TCC in patients with
SIRS/septic shock using two different membranes. Contrib nephrol
1995; 116: 89-98.
-
Ronco
C, Tetta C, Lupi A, et al. Removal of platelet-activating factor in
experimental continuous arteriovenous hemofiltration. Crit Care Med
1995; 23: 99-107.
-
Heering P, Morgera S, Schmitz FJ, et al. Cytokine removal and
cardiovascular hemodynamics in septic patients with continuous veno-venous
hemofiltration. Int Care Med 1997; 23: 288-296.
Jose Ángel Sánchez-Izquierdo Riera
Hospital Doce de Octubre, Madrid
©REMI,
http://remi.uninet.edu. Enero 2005.
Palabras clave:
Sepsis grave, Shock séptico,
Fracaso renal agudo, Técnicas continuas de depuración extracorpórea.
Busque en REMI con Google:
Envía tu comentario para su
publicación |
|
|
|