| Autores: Eduardo Domínguez Pardo, Jose Manuel
Gómez García Manejo de la sepsis
pancreática
[Versión para imprimir] [Comentario
Caridad Soler]
Introducción
La pancreatitis aguda (PA) es un proceso inflamatorio del
páncreas, que puede cursar con complicaciones locales y sistémicas. En el
80-90% de los casos presenta un curso clínico leve y autolimitado, con edema
intersticial de la glándula pancreática (PA edematosa), que se
resuelve de forma espontánea entre 5 y 7 días, denominándose pancreatitis
aguda leve o moderada, con cifras de mortalidad inferiores al 1%. En el
10-20% de los casos restantes se presenta con un curso clínico grave que
evoluciona a fallo multiorgánico y/o complicaciones locales como la necrosis
pancreática, el abceso pancreático y el pseudoquiste pancreático,
denominándose pancreatitis aguda grave (PAG), asociándose a cifras
globales de mortalidad en torno al 30-40% [1]. En la PAG con necrosis
pancreática (PAN) se reconocen dos estadios evolutivos (Figura 1): 1-
Fase precoz o PAN estéril (primeras 2 semanas): Aquella que cursa con
necrosis pancreática estéril, que puede desarrollar un síndrome de respuesta
inflamatoria sistémica y eventualmente disfunción multiorgánica, con cifras
de mortalidad de aproximadamente el 10%. 2- Fase tardía o PAN infectada
(más de 2 o 3 semanas): Infección de la necrosis pancreática que cursa con
sepsis y puede evolucionar a shock séptico y disfunción multiorgánica, con
cifras de mortalidad mayores del 80% [2, 3].
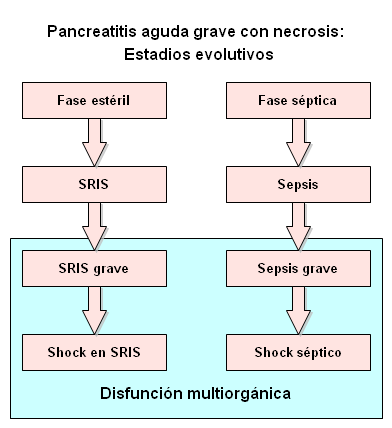
Fig. 1
Existen dos complicaciones infecciosas en la pancreatitis
aguda: La Necrosis pancreática infectada y el Abceso pancreático,
con diferente pronóstico y tratamiento.
Necrosis pancreática infectada
La necrosis pancreática infectada es una complicación
grave y un factor independiente de riesgo para la mortalidad en los
pacientes con PAG. Los principales factores de riesgo para la sobreinfección
de la necrosis pancreática son: a) Extensión de la necrosis pancreática
(cuando el área necrótica es inferior al 50% se produce infección en el 25%,
mientras que cuando el área necrótica es de más del 50% de la glándula la
incidencia de infección es del 85%) y la b) Duración del proceso
inflamatorio (incidencia de infección menor del 15% en las primeras 2
semanas, y de hasta el 70% a partir de las 3ª semana) [4, 5].
Respecto a la patogénesis de la necrosis pancreática
infectada, se postula que la alteración de los mecanismos de defensa del
huésped en el foco de necrosis constituye un estado de alta vulnerabilidad
para la sobreinfección bacteriana. Se acepta que la traslocación bacteriana
desde el tracto digestivo (intestino) es el principal mecanismo
fisiopatogénico, sin poder descartarse otros mecanismos como la
diseminación hematógena, la vía linfática o la vía ascendente (desde la vía
biliar hacia el conducto pancreático principal); este último mecanismo está
relacionado fundamentalmente con procedimientos invasivos realizados sobre
la vía biliar.
A.- Patógenos implicados en la
necrosis pancreática infectada
Los patógenos más frecuentemente implicados en la
infección de la necrosis pancreática son los bacilos gram-negativos de
origen entérico (50-70%) [6], principalmente E. coli, Pseudomonas
ssp, Enterobacter, Bacteroides, Proteus y Klebsiella.
En segundo lugar, los cocos gram-positivos, que se aíslan cada vez con mayor
frecuencia, como resultado de la diseminación hematógena, la vía ascendente
tras procedimientos invasivos y por la selección bacteriana producida por la
antibioterapia profiláctica de amplio espectro. Las infecciones fúngicas,
cuyo principal exponente son las Candida ssp, han experimentado un
incremento en su incidencia, fundamentalmente debido a la generalización del
uso de la profilaxis antibiótica de amplio espectro [7]. En la fase precoz de la
necrosis pancreática se aíslan predominantemente bacilos gram-negativos de
origen entérico; siendo más característico el aislamiento de gram-positivos,
hongos y otros patógenos multirresistentes en las fases más tardías del
proceso [6], debido fundamentalmente a la alteración de la flora bacteriana
inducida por la profilaxis antibiótica de amplio espectro.
B.- Diagnóstico de la pancreatitis aguda grave
necrotizante
Los criterios para valorar la gravedad de una PA (Tabla I) se basan en:
|
|
Tabla I. Criterios precoces de gravedad en la
pancreatitis aguda
|
| |
|
|
| Al ingreso |
A las 24 horas |
A las 48 horas |
| Valoración clínica |
Valoración clínica |
Valoración clínica |
| Fracasos orgánicos |
Fracasos orgánicos |
Fracasos orgánicos |
| APACHE-II |
APACHE-II |
APACHE-II |
|
Índice de masa corporal |
E-PMN* PAT-PACAP* |
PCR |
|
* Estudios experimentales |
Criterios clínicos
Los parámetros clínicos (tensión arterial, frecuencia
cardiaca, frecuencia respiratoria, ritmo de diuresis, intensidad del dolor,
signo de Grey-Turner, signo de Cullen ....) recogidos en la fase inicial de
la PA son, en términos generales, malos predictores de la gravedad de la PA,
presentando una alta especificidad pero una baja sensibilidad en las
primeras 24 horas de evolución, y mejorando su valor discriminativo a las 48
horas. La presencia de disfunción multiorgánica inicial en el seno de un
episodio agudo de PA no es un buen predictor de gravedad, ya que solo se
produce en aproximadamente en un 50% de las PA graves que posteriormente
desarrollarán complicaciones.
Puntuaciones de gravedad
Los sistemas multifactoriales de gravedad [8] (criterios de Ranson y de Imrie) (Tablas II y III) tienen muchas limitaciones a la hora de
predecir la gravedad de un episodio de PA, principalmente por su escasa
capacidad para detectar las formas graves, su baja sensibilidad en la
valoración inicial y la necesidad de 48 horas de evolución del cuadro para
completar todos los criterios. El mejor sistema de valoración multifactorial
para predecir la gravedad de una PA es la escala de gravedad sistémica
APACHE II [9], por sus mejores cifras de sensibilidad y especificidad, su
precocidad (eficaz en las primeras 24 horas) y la posibilidad de usarse como
escala de seguimiento evolutivo de la gravedad de la PA. Conviene reseñar la
combinación de la escala de gravedad APACHE-II y el Indice de Masa Corporal
(IMC), conocido como el APACHE-O [10], que mejora ostensiblemente la precisión y
eficacia en establecer el pronóstico de gravedad en un brote de PA. Un
APACHE-II > 8 y un APACHE-O > 6 tienen una alta sensibilidad y especificidad
para detectar formar graves de PA en las primeras 24 horas de evolución del
cuadro.
|
Tabla II. Criterios de gravedad de Ranson
|
| |
|
| Al ingreso |
A las 48 horas |
| Edad > 55 años |
Descenso del Hto > 10% |
| Leucocitosis > 16.000/mm3 |
Aumento del BUN > 5 mg/dL |
| Glucemia > 200 mg/dl |
Calcemia < 8 mg/dl |
| LDH > 350 U/L |
pO2 < 60 mmHg |
|
GOT > 250 U/dL |
Déficit de bases > 4 mmol/L |
| |
Retención de líquidos > 6 L |
| |
|
Tabla III. Escala pronóstica de Imrie |
| (en cualquier momento dentro de
las primeras 48 horas del ingreso) |
| Edad > 55 años |
pO2 < 60 mmHg |
| Leucocitos > 15.000/mm3 |
Calcemia < 8 mg/dl |
| Glucemia > 180 mg/dl |
LDH > 600 UI/L |
| BUN > 45 mmol/L |
GOT o GPT > 200 U/dL |
| |
Albúmina < 32 gr./L |
| |
|
Marcadores biológicos
Los marcadores biológicos han supuesto un avance para
discriminar entre formas leves y formas graves en la fase precoz de la PA.
El marcador biológico principal (“patrón de oro”) es la Proteína C reactiva
(PCR) [11], reactante de fase aguda, sintetizado a nivel hepático, cuyos niveles
plasmáticos se correlacionan linealmente con la gravedad de la PA y la
existencia de necrosis pancreática. Es una prueba de determinación sencilla
y económica, con alta disponibilidad, cuyo principal inconveniente es la
necesidad de obtener la determinación a las 48 horas de evolución del
cuadro, para obtener los mejores valores discriminativos. Su punto de corte
(a las 48 horas) es de 150 mg/dl y los valores de sensibilidad y
especificidad son del 80% y del 75%, respectivamente. Existen otros
marcadores biológicos en fase de estudio experimental [12], cuyos resultados son
alentadores para la predicción de la gravedad en la fase precoz de la PA,
como son la elastasa polimorfonuclear (E-PMN), la procalcitonina (PCT) y los
péptidos urinarios de activación de las proteasas: péptidos de activación
del tripsinógeno (PAT) y péptido de activación de la carboxipeptidasa (PACAP).
Criterios radiológicos
Los criterios radiológicos permiten estratificar la
gravedad de la PA con gran fiabilidad. La realización de una TC simple
[13] permite realizar una primera clasificación (criterios tomográficos clásicos
de Balthazar) radiológica de la gravedad de la PA en 5 grados (A-E); además
permite una adecuada valoración de la morfología pancreática y de los
tejidos peripancreáticos (Tabla 4). La TC dinámica (con contraste
intravenoso) debe realizarse en aquellos pacientes con criterios clínicos y
biológicos de gravedad (Ransom > 3; APACHE II > 8; PCR > 150) entre las 72 y
120 horas de evolución del cuadro, para evaluar un factor pronóstico de
gravedad como es la necrosis pancreática y completar la clasificación
radiológica con el "Índice de Gravedad Tomográfica" (IGT) [14] en el cual se une
la clasificación de la TC simple de Balthazar (grado A-E) con una puntuación
en función del porcentaje de necrosis de la glándula pancreática, obteniendo
una puntuación pronóstica (0-3: PA Leve; 3-6: PA Grave; 7-10: PA
Necrotizante), estrechamente relacionado con el riesgo de complicaciones y
la mortalidad (Tabla 5).
|
Tabla IV. Criterios tomográficos clásicos de
Balthazar
|
| |
|
| Grado |
Descripción morfológica |
| A |
Páncreas normal |
| B |
Aumento focal o difuso del
tamaño pancreático, alteración del contorno glandular |
| C |
Alteraciones intrapancreáticas, con afectación de la grasa peripancreática |
| D |
Coleccón líquida única mal
definida |
|
E |
Dos o más colecciones líquidas
mal definidas. Gas pancreático o retroperitoneal |
| |
|
Tabla V. Índice de gravedad tomográfica
|
| |
|
|
|
Extensión de la pancreatitis |
Extensión de la necrosis |
| Grado |
Puntos |
Extensión |
Puntos |
| A |
0 |
No necrosis |
0 |
| B |
1 |
≤ 30% |
2 |
| C |
2 |
30-50% |
4 |
| D |
3 |
> 50% |
6 |
|
E |
4 |
|
|
| |
C.- Diagnóstico de la necrosis
pancreática infectada
El deterioro clínico, la fiebre y leucocitosis mantenida
tras excluir otros focos de infección, la disfunción orgánica no resuelta,
los niveles de PCR persistentemente elevados (> 150 mg/dl) a partir del
7º-10º día de evolución y la presencia de gas peripancreático en la TC son
datos indirectos que sugieren la posibilidad de sobreinfección de la
necrosis pancreática. La prueba confirmatoria de la infección de la necrosis
pancreática es el estudio microbiológico del material obtenido mediante
punción-aspiración con aguja fina (PAAF) guiada por TC o ecografía de la
necrosis pancreática o peripancreática. El material obtenido tras la punción
debe ser procesado de forma inmediata para la realización de una tinción de
gram y cultivo. Se ha demostrado que una tinción de gram positiva es un
indicador fiable de necrosis pancreática infectada [15, 16]. Es una técnica precisa, segura y fiable para el diagnóstico de
necrosis pancreática infectada, con un riesgo potencial de contaminación de
la muestra. Su precisión es alta (tabla VI), con una baja tasa de
complicaciones, como la punción de un asa intestinal, el sangrado o la
exacerbación de un brote de pancreatitis.
|
Tabla VI. Validez diagnóstica de la PAAF en la
necrosis pancreática infectada
|
| |
| |
n |
Pr |
S |
E |
VPP |
VPN |
| Rau y col.
[16] |
94 |
37 |
83 |
93 |
88 |
90 |
| Gerzof y col. [15] |
60 |
46 |
100 |
100 |
100 |
100 |
|
n: número de casos; Pr: prevalencia de infección (%); S: sensibilidad (%);
E: especificidad (%); VPP: valor predictivo positivo (%); VPN: valor
predictivo negativo (%) |
D.- Antibioterapia profiláctica
en la pancreatitis aguda grave
En base a los estudios realizados por el grupo de Ulh
[17], se
conoce que la sobreinfección de la necrosis pancreática con el desarrollo de
sepsis pancreática es la complicación más grave de la pancreatitis aguda
grave, con elevadas tasas de mortalidad. Existen evidencias de que la
administración profiláctica de antibióticos podría disminuir la incidencia
de infección de la necrosis pancreática y la mortalidad del cuadro, aunque
es materia de controversia científica el beneficio clínico real obtenido con
la antibioterapia profiláctica de amplio espectro. Además, hay que reseñar
que ninguno de los estudios disponibles sobre la antibioterapia profiláctica
sistémica tiene el tamaño muestral suficiente para detectar diferencias
estadísticas en la mortalidad.
Existen 2 metaanálisis [18, 19] que
comparan la terapia antibiótica profiláctica frente a un grupo control (sin
tratamiento) en los pacientes con PA necrotizante. En ambos se obtuvo una
reducción significativa en las cifras de mortalidad, complicaciones sépticas
y necesidad de cirugía. Tras un análisis detallado de los estudios
seleccionados en ambos metaanálisis, se ha argumentado que la ausencia de
resultados homogéneos en los estudios, la variabilidad de los criterios de
inclusión, la baja calidad metodológica, los distintos regímenes
antimicrobianos usados y la no inclusión del único estudio aleatorizado y
doble ciego [3] realizado hasta la fecha hacen cuestionable la
indicación de la terapia antibiótica profiláctica en pacientes con PA grave.
En el estudio de Pederzoli y col. [20], que incluyó 74 pacientes con PA necrotizante de causa biliar, con un Ransom (medio) de 3,7, la
administración de imipenem-cilastatina, se asoció a una reducción de la
incidencia de sepsis pancreática (del 30,3% al 12,2%) y extrapancreática
(48,5% al 14,6%) estadísticamente significativa (p < 0,01), sin disminuir la
incidencia de disfunción orgánica, la necesidad de tratamiento quirúrgico y
la mortalidad. Este estudio plantea la cuestión de si la supuesta evolución
clínica favorable atribuible a la antibioterapia profiláctica es debida a
fundamentalmente a una reducción de la incidencia de infecciones
nosocomiales, en lugar de una reducción de la sobreinfección de la necrosis
pancreática. El estudio de Sainio y col. [21], que incluyó 60 pacientes con
pancreatitis necrotizante de causa alcohólica, con un Ranson medio de 5,5,
administrando cefuroxima demostró una reducción estadísticamente
significativa de las complicaciones infecciosas en el grupo de la
antibioterapia profiláctica. El análisis detallado de las complicaciones
infecciosas demostró un número desproporcionado de infecciones urinarias
(que solo se redujeron en el grupo tratamiento) y una alta tasa de infección
por S. epidermidis, que impide una correcta interpretación de los
resultados obtenidos. El estudio de Schwarz y col. [22], que incluyó 26 pacientes
con pancreatitis aguda necrotizante de origen biliar, con similar extensión
de la necrosis pancreática, administrando una pauta de ofloxacino +
metronidazol no encontró diferencias en la tasa de sobreinfección de la
necrosis pancreática, fallo orgánico y mortalidad del proceso. El estudio de
Nordback y col [23]. incluyó 58 pacientes, y los que recbiieron profilaxis
antibiótica con imipenem tuvieron una menor mortalidad (2% frente a 5% en el
grupo control; p = 0,04). (Tabla VII).
En 2 estudios se compararon diferentes regímenes
antibióticos para la profilaxis de la pancreatitis aguda grave. Bassi y
col. [24], aleatorizaron 60 pacientes con pancreatitis aguda necrotizante a
recibir perfloxacino o imipenem durante 14 días, encontrándose una reducción
significativa en la incidencia de infección de la necrosis pancreática en
aquellos pacientes que recibieron imipenem (34% frente a 10%; p = 0,03), sin
obtener diferencias significativas en las cifras de mortalidad (24% frente a
10%; p = 0,18). Se aisló mayor número de cepas bacterianas resistentes en el
grupo de tratamiento con perfloxacino. Manes y col. [25] aleatorizaron 176
pacientes a recibir meropenem frente a imipenem durante 14 días, sin
encontrar diferencias significativas respecto a las complicaciones sépticas,
intervenciones quirúrgicas y cifras de mortalidad (13,6% frente a 11,4%). De
estos resultados se concluye que: 1) el imipenem es superior al perfloxacino
y tiene una eficacia similar al meropenem; 2) la combinación de quinolonas +
metronidazol no es una pauta efectiva como antibioterapia profiláctica; y 3)
la duración del tratamiento antibiótico profiláctico de 2 semanas parece ser
efectiva (Tabla VII).
En el estudio de Isenmann y col. [3], el único ensayo clínico
controlado aleatorizado, multicéntrico y doble ciego, se incluyeron 114
pacientes (76 con PA necrotizante), con un Ranson medio de 2-3. Los
pacientes fueron aleatorizados a recibir una combinación de quinolonas +
metronidazol frente a placebo. No se demostraron diferencias significativas
en las tasas de infección de la necrosis pancreática (12% grupo tratamiento
frente a 9% grupo control), cifras de mortalidad (5% grupo tratamiento
frente a 7% grupo control), disfunción orgánica, complicaciones sistémicas y
necesidad de cirugía. Conviene destacar el hecho de que hasta un 20% de las
cepas bacterianas de los pacientes del grupo placebo eran resistentes a la
combinación de quinolonas + metronidazol, cuestionando la eficacia de este
régimen. Este estudio plantea una serie de cuestiones respecto a la
antibioterapia profiláctica en la PA grave: a) los pacientes con PA de grado
leve-moderado no se benefician de la antibioterapia profiláctica; b) es
conveniente seleccionar la indicación de la antibioterapia profiláctica a
aquellos pacientes con disfunción orgánica precoz y/o necrosis pancreática
superior al 30%; y c) las pautas antibióticas con carbapenémicos (imipenem o
meropenem) son claramente superiores a las que incluyen quinolonas +
metronidazol.
Existe controversia respecto a si el uso de la terapia
antibiótica profiláctica podría modificar la flora bacteriana en la necrosis
pancreática, con una selección de la flora bacteriana y una incidencia
predominante de sobreinfección de la necrosis pancreática por bacterias gram
positivas y hongos. Hasta el 25% de los pacientes con necrosis pancreática
que no reciben antibióticos desarrollan infecciones fúngicas, con una
mortalidad de hasta el 85%. La incidencia de infecciones fúngicas se
correlaciona con la extensión de la necrosis y la gravedad del cuadro. En
cuatro ensayos clínicos aleatorizados sobre la antioterapia empírica
profiláctica [3, 20-22] se recogieron los datos
respecto a la incidencia de sobreinfección fúngica (en ninguno de ellos era
el objetivo primario), obteniendo tasas de infección fúngica menores del 7%
en tres de ellos, y del 20% en un estudio de pequeño tamaño muestral [22].
En base a estos hallazgos se concluye que la antibioterapia profiláctica no
produce un incremento en la incidencia de infecciones fúngicas, y se postula
que el tratamiento precoz con antifúngicos podría reducir la incidencia de
estas sobreinfeciones, cuestión a aclarar en futuros estudios debidamente
diseñados.
Por último, conviene destacar que una identificación
precoz y más precisa de aquellos factores de riesgo que favorecen la
infección de la necrosis pancreática permitiría ser más específico al
indicar el tratamiento profiláctico, optimizando los beneficios y
minimizando los riesgos. Se ha sugerido que la procalcitonina (PCT) [12], propéptido activo de la calcitonina, podría ser útil para diagnosticar la
infección pancreática en fase precoz.
En base a lo expuesto anteriormente, y a pesar de que no
existen datos concluyentes al respecto [26], se acepta que:
-
La administración profiláctica de antibióticos
sistémicos podría disminuir la incidencia de infección de la necrosis
pancreática y consecuentemente la mortalidad.
-
La antibioterapia profiláctica de elección son los
carbapenémicos (imipenem o meropenem), reservándose la pauta de quinolonas
+ metronidazol para aquellos pacientes alérgicos a beta-lactámicos.
-
La duración del tratamiento antibiótico sistémico
profiláctico aceptada por la mayoría de los autores es de 2 semanas,
prolongándose la duración si persisten las complicaciones locales o
sistémicas no sépticas o si los niveles de PCR se mantienen por encima de
120 mg/dl.
-
Es de vital importancia ajustar el régimen antibiótico
al espectro de resistencia antimicrobiana del centro hospitalario para
lograr una profilaxis antibiótica adecuada. Por su espectro antimicrobiano,
el imipenem y el meropenem parecen especialmente indicados.
Estudios experimentales sugieren que la descontaminación
selectiva del tracto digestivo (DDS) con antibióticos no absorbibles
constituyen una estrategia alternativa eficaz para eliminar los patógenos
bacterianos de la flora intestinal, reducir los episodios de traslocación
bacteriana y disminuir la incidencia de sobreinfección de la necrosis
pancreática. En el único estudio clínico de descontaminación digestiva
selectiva [27] publicado hasta la fecha, se aleatorizaron 102
pacientes con PA grave a recibir una combinación de sulfato de colistina,
anfotericina y norfloxacino por vía oral y rectal (enemas), hasta la
completa erradicación de la flora microbiana de la cavidad oral y del
recto., suplementándose la pauta con terapia antibiótica profiláctica
sistémica con cefotaxima intravenosa. Se constató una reducción
significativa en las cifras de mortalidad en el grupo de DDS (mortalidad 22%
en el grupo de DDS y del 35% en el grupo control; p < 0,05),
fundamentalmente a expensas de la mortalidad tardía (> 2 semanas), y con una
reducción significativa (p = 0,003) de las tasas de sobreinfección de la
necrosis pancreática por microorganismos gram negativos. A pesar de estos
resultados, no es posible obtener conclusiones definitivas respecto a la DDS
por la combinación de antibióticos no absorbibles y sistémicos, que impide
determinar qué componente del tratamiento es el responsable del beneficio.
En la actualidad, no puede recomendarse el uso sistemático de la
descontaminación digestiva selectiva (DDS) en la PA grave para prevenir la
sepsis pancreática.
Existe una nueva indicación en el manejo intensivo de la
PAN con sepsis grave, en aquellos pacientes con APACHE-II > 24 y/o fallo de
2 o más órganos en las primeras 24 horas y con ausencia de
contraindicaciones: La drotrecogina alfa activada (Proteína C activada),
administrada durante 96 horas, en perfusión intravenosa a un ritmo de 24 µgr/kg/h,
asociada al mejor tratamiento estándar de la sepsis grave (terapia
resucitadora dirigida, antibioterapia de amplio espectro adecuada, terapia
esteroidea sustitutiva, …), respetando los intervalos de interrupción del
fármaco durante los procedimientos invasivos (intervención quirúrgica /
punción percutanea → suspender 2 horas y reiniciar 12 horas después).
|
Tabla VII. Ensayos clínicos de antibioterapia
profiláctica en la PA grave
|
| |
| |
Fármaco |
Nº pacientes |
Infección % |
FMO % |
Mortalidad % |
| Pederzoli |
Imipenem |
41 |
33 |
12 |
30 |
29 |
39 |
7 |
12 |
| Sainio |
Cefuroxima |
30 |
30 |
30 |
40 |
|
|
3 |
23 |
| Schwarz |
Oflo+metro |
13 |
13 |
61 |
53 |
|
|
0 |
15 |
| Nordback |
Imipenem |
25 |
33 |
|
|
7 |
25 |
2 |
5 |
| Bassi |
Perflo/imipenem |
30 |
30 |
34 |
10 |
|
|
24 |
10 |
| |
Enlaces:
-
Baron TH,
Morgan DE. Acute necrotizing pancreatitis. N Engl J Med 1999; 340:
1412-1417.
-
Heinrich S,
Schäfer M, Rousson, et al. Evidence-based treatment of acute pancreatitis.
Ann Surg 2006; 243: 154-168.
-
Issenmann R;
Runzi M, Kron M, et al. Prophylactic antibiotic treatment in patients with
predicted severe acute pancreatitis: a placebo-controlled, double-blind
trial. Gastroenterology 2004; 126: 997-1004.
-
Nathens A,
Randall J, Beale J, et al. Management of the critically ill patient with
severe acute pancreatitis. Crit Care Med 2004; 32: 2524-2536.
-
Wyncoll DL. The
management of severe acute necrotizing pancreatitis: an evidence-based
review of the literature. Intensive Care Med 1999; 25: 146-156.
-
Bassi C, Larvin
M, Villatoro E. Antibiotic therapy for prophylaxis against infection of
pancreatic necrosis in acute pancreatitis. Cochrane Database Syst Rev
2003: CD002941.
-
Lankisch PG,
Markus M. The role of antibiotic prophylaxis in the treatment of acute
pancreatitis. J Clin Gastroenterol 2006; 40: 149-155.
-
Ranson JHC,
Rifkind KM, Roses DF et al. Prognostic sign and the role of operative
management in acute pancreatitis. Surg Gynecol Obstet 1974; 139: 69-81.
-
Larvin M, Mc
Mahon MJ. APACHE-II score for assessment and monitoring of acute
pancreatitis. Lancet 1989; 2: 201-205.
-
Tohn SKC,
Walters J, Johson CD. APACHE-O. A new predictor of severity in acute
pancreatitis. Gastroenterology 1996; 110: A 437.
-
Wilson C, Heads
A, Shenkin A et al. C-reactive protein, antiproteases and complement
factors as objective markers of severity in acute pancreatitis. Br J Surg
1989; 76: 177-181.
-
Muller CA, Uhl
W, Printzen G et al. Role of procalcitonin and granulocyte colony
stimulating factor in the early prediction of infected necrosis in severe
acute pancreatitis Gut 2000; 46: 233-238.
-
Balthazar EJ,
Ranson JHC, Naidich DP et al. Acute pancreatitis: Prognostic value of CT.
Radiology 1985: 156: 767-772.
-
Balthazar EJ.
Complications of acute pancreatitis. Clinical and CT evaluation. Radiol
Clin North Am 2002; 40: 1211-1227.
-
Gerzof SG,
Banks PA, Robbins AH et al. Early diagnosis of pancreatic infection by
computed tomography-guided aspiration. Gastroenterology 1987; 93:
1315-1320.
-
Rau B, Pralle
U, Mayer JM et al. Role of ultrasoundgraphically guided fine-needle
aspiration cytology in the diagnosis of infection pancreatic necrosis. Br
J Surg 1998; 85: 179-184.
-
Uhl W, Warshaw
A, Imrie C, et al. Guidelines for the surgical management of acute
pancreatitis. Pancreatology 2002; 2: 565-573.
-
Sharma VK,
Howden CW. Prophylactic antibiotic administration reduces sepsis and
mortality in acute necrotizing pancreatitis: a metaanalysis. Pancreas
2001; 22: 28 – 31.
-
Golub R,
Siddiqi F, Pohl D et al. Role of antibiotics in acute pancreatitis: a
metaanalisis. J Gastrointest Surg 1998; 2: 496-503.
-
Pederzoli P,
Bassi C, Vesenteni S, et al. A randomized multicenter clinical trial of
antibiotic prophylaxis of septic complications in acute necrotizing
pancreatitis with imipenem. Surg Gynecol Obstet 1993; 176: 480-483.
-
Sainio V,
Kemppainem E, Puolakkainem P, et al. Early antibiotic treatment in acute
necrotizing pancreatitis. Lancet 1995; 346: 663-667.
-
Schwarz M,
Isenmann R, Meyer H, et al. Antibiotic use in necrotizing pancreatitis:
results of a controlled study. Dtsch Med Wochenschr 1997; 122: 356-361.
-
Nordback I,
Sand J, Saaristo R, et al. Early treatment with antibiotics reduces the
need of surgery in acute necrotizing pancreatitis: a single-center
randomized study. J Gastrointest Surg 2001; 5: 113-118.
-
Bassi C,
Falconi M, Talami G, et al. Controlled clinical trial of perfoxacin versus
imipenem in severe acute pancreatitis. Gastroenterology 1998; 115:
1513-1517.
-
Manes G,
Ravitti PG, Menchise A, et al. Prophilaxis with meropenem of septic
complications in acute pancreatitis: a randomized, controlled trial versus
imipenem. Pancreas 2003; 27: 379-383.
-
SEMYCIUC:
Conferencia de consenso sobre la pancreatitis aguda grave en Medicina
Intensiva. Medicina Intensiva 2005; 29: 279-304.
-
Luitien EJ, Hop
WC, Lange JF, et al. Controlled clinical trial of selective
decontamination for the treatment of severe acute pancreatitis. Ann Surg
1995; 222: 57-65.
Enlaces:
-
2005
Recomendaciones de la 7ª Conferencia de Consenso de la SEMICYUC.
Pancreatitis aguda grave en Medicina Intensiva. Maraví E, Jiménez I, Gener
J, Zubia F, Pérez M, Casas JD, Montejo JC, García A, López V, Fernández E,
Álvarez F, Vallés J, Olaechea P, Domínguez E,. Tellado JM, Landa I,
Lafuente J, Villalba C, Sesma J. Med Intensiva 2005; 29: 279-304. [Texto
completo] [PDF
280 Kb, 26 pág]
-
UK guidelines
for the management of acute pancreatitis. Gut 2005; 54: 1-9. [PDF
126 Kb]
Eduardo Domínguez Pardo, Jose Manuel Gómez García
Hospital Gregorio Marañón, Madrid
©REMI, http://remi.uninet.edu.
Febrero
2007.
Palabras clave: Pancreatitis aguda, Necrosis
pancreática, Sepsis pancreática.
Envía tu comentario para su
publicación |